Konzentration beeinflusst Spannung?
Also das galvanische element hat folgende Konzentrationen:
c(ZnSO4) = 0.05mol/l
c(CuSO4) = 1.7 mol/l
Die Aufgabe lautet: Im laufe der Verwendung verändert sich die Konzentration der Elektrolytlösungen, erklären Sie diesen Umstand und treffen sie eine Aussage, in welche Richtung sich die Konzentration ändert und inwiefern dies die Spannung beeinflusst.
Ich steh irgendwie vorallem bei dem Einfluss auf die Spannung auf dem Schlauch :(
Hilfee
1 Antwort
Du hast also ein Kupfer-Zink-Element mit den Konzentrationen c(Cu²⁺)=1.7 mol/l und c(Zn²⁺)=0.05 mol/l. Da Kupfer das edlere Metall ist, läuft die folgende Reaktion ab:
Zn + Cu²⁺ ⟶ Zn²⁺ + Cu
- Am Zinkblech wird metallisches Zink zu Zn²⁺ oxidiert, also ist das die Anode. Wenn sich die Zink-Ionen mitsamt ihrer positiven in die Lösung vertschüssen, dann bleibt am Zinkblech eine negative Lasung zurück, es ist also der Minuspol.
- Am Kupferblech werden Cu²⁺-Ionen zu Cu-Metall reduziert, also ist das die Kathode. Wenn sich die positiven Ionen darauf niederschlagen, bleibt die Ladung übrig, also ist das der Pluspol.
Für die Spannung schauen wir uns die Standardreduktionspotentiale an: ε⁰(Cu²⁺/Cu)=+0.337 V und ε⁰(Zn²⁺/Zn)=−0.762 V, daher ist ΔE⁰, die Spannung für Standardkonzentrationen, gleich 1.099 V. Für die Umrechung auf unsere Konzentrationen benutzen wir die Nernst-Gleichung:

Wenn ich mich dabei nicht verrechnet habe, dann kommen 1.14 V heraus, das ist nur eine kleine Korrektur gegenüber der Spannung bei Standardkonzentrationen.
Im Lauf der Zeit wird natürlich c(Zn²⁺) steigen (weil es von der Reaktion produziert wird) und umgekehrt c(Cu²⁺) sinken, so daß die Spannung langsam abnehmen wird — wie langsam hängt vom Stromfluß ab und vom Volumen der Elektrodenlösungen.
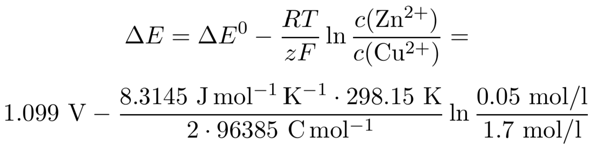
Schau Dir die Nernst-Gleichung in meiner Antwort an — nach längerer Laufzeit ist c(Zn²⁺)>0.05 mol/l und entsprechend c(Cu²⁺)<1.7 mol/l, und wenn Du jetzt die Spannung neu ausrechnest, bekommst Du natürlich einen kleineren Wert.
Aber wieso wird der Wert denn kleiner ich dachte, dass je grösser die Konzentrationsdifferenz ist die Potentialdifferenz auch größer wird und damit ja auch die Spannung
Mach doch den Versuch und setze 0.2 mol der Substanzen um. Dann ist c(Cu²⁺)=1.5 mol/l und c(Zn²⁺)=0.25 mol/l; die Zellspannung beträgt dann nur noch ΔE=1.12 V, auszurechnen mit derselben Formel wie oben.
Aber wieso wird dann die Spannung abnehmen, wenn die Konzentration der Zinkionen steigt und die der Kupferionen sinkt? Das verstehe ich nicht können sie mir das vielleicht genau erklären 😊?