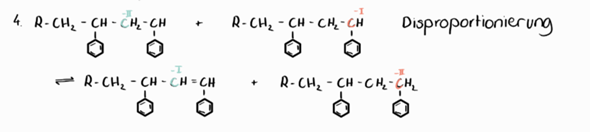
Ist das so richtig?
Chemie Thema: Polymerisation
3 Antworten
Moin,
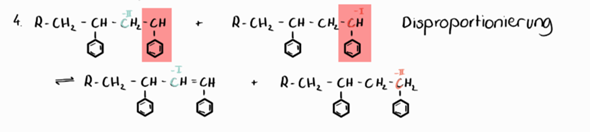
deine Abbildung stimmt fast. Aber es fehlen die ungepaarten Elektronen! Du hast das Wort „Disproportionierung” an den Rand geschrieben.
Das lässt auf einen radikalischen Reaktionsmechanismus schließen. Aber Radikale haben ungepaarte Elektronen.
Ich habe mir mal die Mühe gemacht, deine Abbildung etwas genauer darzustellen:
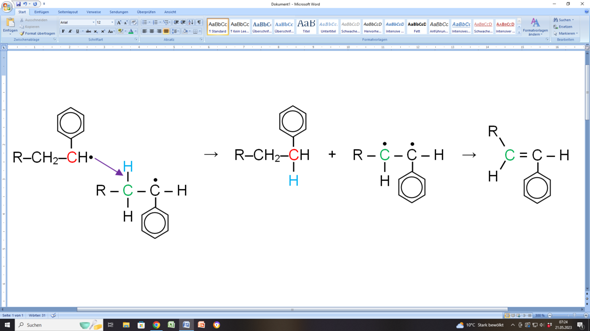
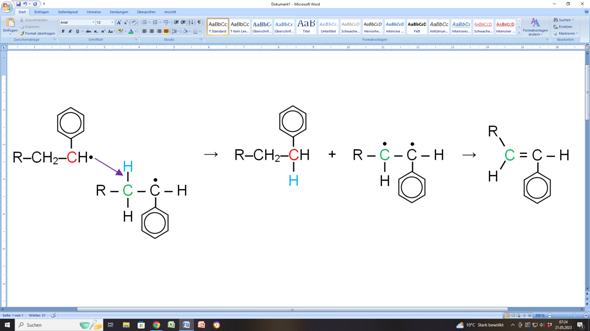
Links siehst du quasi die Ausgangssituation in deiner Abbildung (allerdings auf das Wesentliche beschränkt).
Ein Alkylradikal (rotes C mit ungepaartem Elektron, schwarzer Punkt) greift ein anderes Alkylradikal an dessen CH2-Gruppe (grünes C) in direkter Nachbarschaft zu dessen radikalischen Zustand an. Dabei entreißt das erste Alkylradikal der CH2-Gruppe ein Wasserstoffatom (blaues H) mitsamt dessen Elektron. Das führt dazu, dass das erste Alkylradikal jetzt keinen radikalischen Zustand mehr hat, weil es ja ein Wasserstoffatom mehr hat (rotes C in der Mitte). Das andere Radikal ist jetzt ein Diradikal: Es hat zwei radikalische C-Atome in direkter Nachbarschaft zueinander. Da ist klar, dass sich diese radikalischen Zustände sofort aufheben, indem eine C=C-Doppelbindung ausgebildet wird (Molekül ganz rechts in meiner Darstellung).
Und dann hast du im Prinzip auch die Aussage deiner Darstellung (nur dass bei dir die ungepaarten Elektronen fehlen).
Was die Oxidationsstufen der beteiligten Kohlenstoffatome angeht, so hat das rot markierte C-Atom im ersten Alkylradikal die Oxidationszahl –I (es erhält jeweils ein Elektron aus den Bindungen zum Phenylring bzw. zur CH2-Gruppe zugesprochen, dann beide Elektronen aus der Bindung zum Wasserstoffatom plus das eine ungepaarte Elektron durch seinen radikalischen Zustand; das macht 1 + 1 + 2 + 1 = 5 Elektronen. Da es im ungebundenen Zustand nur 4 Valenzelektronen hätte, hat es hier also ein Elektron mehr nach der Zuteilung, weshalb es die Oxidationszahl –I erhält).
Das grün markierte C-Atom links hat dagegen am Anfang die Oxidationsstufe –II, weil es jeweils ein Elektron aus den Bindungen zu seinen Kohlenstoffnachbarn zugeteilt bekommt, sowie jeweils beide Bindungselektronen aus den Bindungen zu den Wasserstoffatomen. Das macht 1 + 1 + 2 + 2 = 6 Elektronen und deshalb die Oxidationszahl –II.
Am Ende ist es genau umgekehrt. Dann hat das rot markierte C-Atom die Oxidationsstufe –II und das grün markierte C-Atom die Oxidationsstufe –I.
Da also ein Kohlenstoffatom von einer geringeren Oxidationsstufe auf eine höhere ansteigt (oxidiert wird), während ein anderes Kohlenstoffatom gleichzeitig von einer höheren Oxidationsstufe auf eine niedrigere fällt (reduziert wird), spricht man zusammengenommen von einer Disproportionierung...
Du siehst, deine Abbildung stimmt fast; es fehlen nur die ungepaarten Elektronen...
LG von der Waterkant
Wie ich merke ist wohl Knowunity nicht besonders gut zum Lernen.
Nein, das ist nicht richtig!
Hab ganz großes Bauchiaua, bei dem rot markierten Molekülen
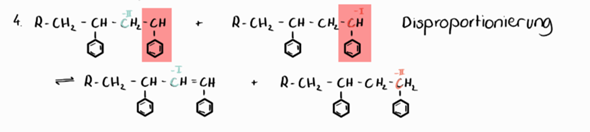
Es fehlen Bindungen! Du hast Deinem C-Atom keine Ladungen gegeben. So wie Du das gezeichnet hast, ist es falsch.
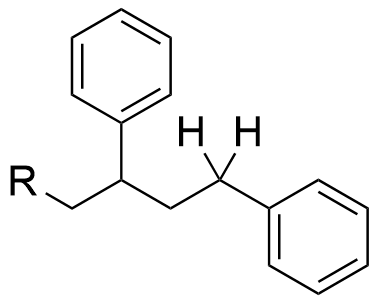
Da fehlt ein H-Atom bei Dir! (Siehe meine Abbildung)
Weiterhin geht nicht hervor, wie hier was initiiert wurde. Insbesondere welche Art der Polymerisation Du hier darstellen möchtest (radikalische, anionische, kationische etc.)
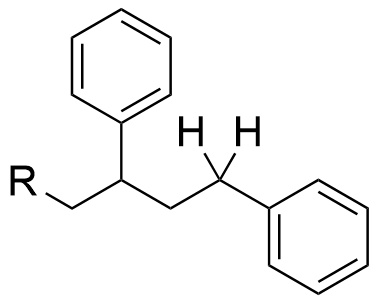
Wie würde man denn eine radikalische Polymerisation kennzeichnen?
Joa, habe ich mir auch gedacht. Habs auf Knowunity gefunden und war sofort skeptisch, danke!
Ich sehe hier keine ungepaarten Elektronen.
Bei einer Disproportionierung haben die Atome des betreffenden Elements am Anfang dieselben Oxidationszahlen.