Hydratisiierung über mesomeriestabilisiertes Allylkation?
Hello hello ihr wunderschönen Menschen,
fast auf den Tag genau 10 Jahre nach meiner letzten Chemie-Schulstunde am 4. Juli 2013 steht nun am 10. Juli 2023 die Chemie-Klausur in der Universität auf dem Stundenplan. Struggeln tun wir gerade an dieser Aufgabe:
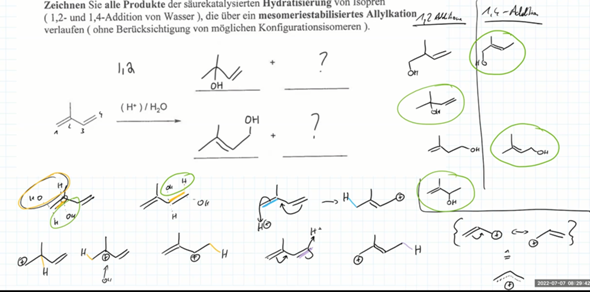
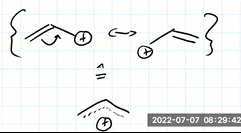
Wir wissen daß ein Allokation so aussieht wie unten in der Graphik beschrieben
Jetzt ist aber unser Problem'sche, daß bei den Lösungen zu 1,2 Addition nur die grün markierten Produkte als Lösung gelten
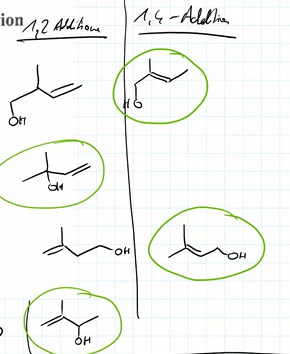
Warum gelten die beiden nicht markierten Produkte nicht als Hydratisierung über mesomeristabiliertes Allykation? Liegt es daran, daß das -OH etwas weiter weg von der Doppelbindung ist?
Um die Verwirrung zu komplettieren hat derrselbe Dozent im Vor-Semester den Kollegen erzählt, daß es 6 (statt 4) mögliche Lösung gibt, unszwar folgende
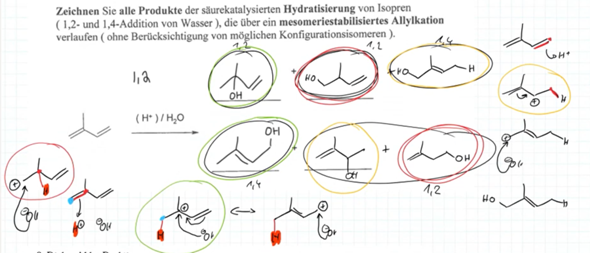
Ich bin wirklich verwirrt und weiß nicht mehr wo vorne und hinten ist. Kann doch nicht sein, daß es im Sommersemester 2022 sechs Produkte einer säurekatalyisierten Hydratisierung von Isopren gibt und 2023 dann nur noch 4
2 Antworten
Ich verstehe die Frage nicht ganz (liegt eher an mir): mein Gefühl sagt mir aber, dass man darauf achten sollte, dass sich Proton und Hydroxid möglichst wenig ins gehege kommen. Das könnte man evtl. mechanistisch begründen.
Höhersubstituierte Alkene sind übrigens thermodynamisch deutlich stabiler.
Also, zuallererst greift ein Proton an der 1-/4-Position an. Am Allyliumkation greift daraufhin ein Hydroxidion zwei möglichen Stellungen an. Ich komme da auch auf vier Möglichkeiten und a-Alkohole.
Mir kommen zumindest die rot umkringelten b-Alkohole sehr falsch vor. Erstens müsste das Proton dann mittig angreifen und zweitens, siehe ganz oben. Über Isomerisierung/Hydridwanderung wäre das vielleicht noch möglich.
Das dürfte zwei Gründe haben. Ist aber "nur" meine Intuition.
Erstens ist die Elektronendichte am primären Kettenende höher.
Zweitens wollen wir ja ein großes delokalisiertes Kation haben, das energetisch viel stabiler ist. Und das ist nun mal das Allylium.
Hab mich schon länger nicht mehr mit OC beschäftigt, daher ist die Antwort mit Vorsicht zu genießen.
Ich würde sagen, das mit den 4 Lösungen stimmt. Denn sofern der Mechanismus über ein mesomeriestabilisiertes Allylkation läuft, muss die Doppelbindung nebendran sitzen. Sonst hätte man ja keine Stabilisierung. Dementsprechend kann die Doppelbindung im fertigen Produkt nicht einfach 2 C-Atome entfernt von dem Hydroxy-C liegen, wie es bei den nicht markierten Produkten der Fall ist.
ok danki, das hatten wir auch schon vermutet. Danke, das ist dann nochmal die Bestätigung😄
Danke für die Antwort, ZitrusLiebe. Warumg reift das Proton denn zuerst an der 1/4-Postion bei. Uns wurde das in der Vorlesung so beigebracht, dass man an die Doppelbindungen jeweils auf der einen Seite ein H und auf der anderen Seite ein OH dranhängt und dann die Bindungen jeweils umklappen.
Also entweder klappt bei der ersten Doppelbindung die innere Bindung nach links und hängt dann ein OH ran oder nach rechts und hängt ein OH dran. Gleiches bei der zweiten Doppelbindung. Wir haben also zuerst alle 1,2 Additionen durchgeführt und danach die 1,4 Addition.
Also verstehe ich Dich richtgi, daß ein Proton (z.b. H) an 1 / 4 angreift. Darauf hin klappt dann die Bindung um und die OH-Gruppe kommt ran um die Proton-Ladung auszugleichen, ne c'est pas? :)