Hybridisierung in Bindungswinkel zu Nachbaratomen?
Hallo,
ich sitze gerade an einer Übungsaufgabe und die Lösung die ich heraus habe kommt mir ein wenig zu einfach vor.
Ich soll die Hybridisierung und die Bindungswinkel zu den Nachbaratomen zu den Kohlenstoffatomen angeben. Ich habe sie grün markiert.
Können die Bindungswinkel stimmen oder muss ich da noch was bei den Doppelbindungen berücksichtigen ?
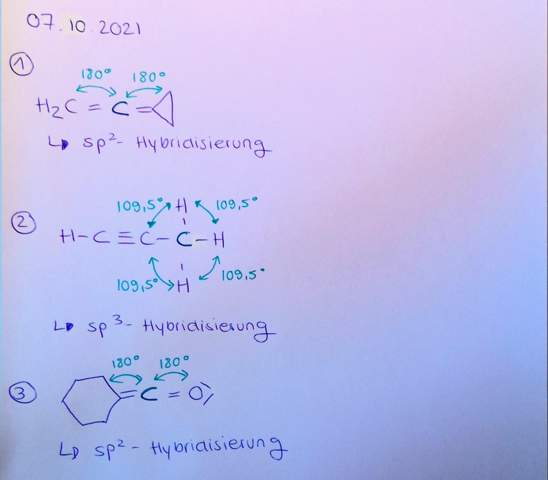
Über eine Antwort würde ich mich wirklich sehr freuen
2 Antworten
Randbemerkung: Die C-Atome habe ich von links nach rechts gelesen.
Molekül 1.
Hybridisierung: Das erste C-Atom ist sp2-Hybridisiert und das zweite C-Atom ist sp-Hybridisiert.
Molekül 2.
Hybridisierung: Das erste und zweite C-Atom ist sp-Hybridisiert, das dritte C-Atom ist sp3-Hybridisiert.
Molekül 3.
Hybridisierung: Das von dir markierte C-Atom (zwischen dem Cyclohexan und dem Sauerstoffatom) hat eine sp-Hybridisierung. Falls du auch das Cyclohexan bestimmen sollst, schau dir am besten mal die Struktur davon an. Dann kannst du auch die Hybridisierung der C-Atome bestimmen.
Bindungswinkel
Die Hybridisierung hat Einfluss auf die Bindungswinkel. Schau dir dazu am besten mal Informationen zum Bindungswinkel an. Gib den Begriff Bindungswinkel bei Wikipedia ein, dann siehst du auch den Zusammenhang zwischen der Hybridisierung und dem Bindungswinkel. Wichtig ist noch zu wissen, dass die Bindungswinkel variieren können. Gute Stichwörter sind da Elektronen, Elektronegativität etc. So wie ich das aber sehe, sieht das bei der Übungsaufgabe ganz gut aus. Du kannst dir auch mal das VSEPR-Modell anschauen.
Viel Erfolg beim Lernen.
Der erste Vogel ist ein kumuliertes System. Die drei Kohlenstoffatome (die zwei der Seitenkette und das daran angebundene C-Atom des Dreieck) liegen also auf einer Gerade, mit Bindungswinkeln 180° am mittleren C (sp-Hybridisierung). Die HCC-Bindungswinkel links liege in der Nähe von 120°, weil das terminale C sp²-hybriisiert ist.
Im Dreiring liegen Bindungswinkel um die 60° vor; formal sind die Hybridisierungen sp² für das Ring-Atom, das die Seitekette trägt, aber sp³ für die beiden anderen. Leider funktioniert das Hybridisierungskonzept für kleine Ringe aber nicht wirklich gut.
Das Molekül ist übrigens nicht planar — alle C-Atome liegen in einer Ebene, aber die H-Atome (sowohl die beiden links als auch die vier im Dreiring) liegen außerhalb dieser Ebene.
Der zweite Vogel sieht wie ein Quirl aus: Die Atome H–C≡C–C liegen auf einer Geraden, also sind alle Bindungswinkel 180°. Die Atome an der Dreifachbindund sind sp-hybridisiert, das rechte C-Atom aber sp³, deshalb erwartet man dort HCC-Bindungswinkel um die 109°.
Das dritte Biest ist ein exocyclisches Keten mit einem sp-hybrisierten C-Atom in der „Seitenkette“. Das daran angeflanschte Ringatom ist sp²-hybridisiert, die anderen Atome im Ring sp³. DIe Bindungswinkel in so einem Ring sind ein bißchen schwierig vorauszusagen, vermutlich nicht weit von 120° bzw. 109° entfernt. Der Ring ist sicherlich nicht planar, sondern irgendwie gefaltet; ich würde eine verzerrte Krone erwarten, ähnlich wie im Cyclohexanon.
Ich habe mir bei der Aufgabe irgendwie gedacht, das es sich bei einer Doppelbindung automatisch um eine sp2-Hybridisierung handeln muss.
Danke für die Antwort, sehr hilfreich !!