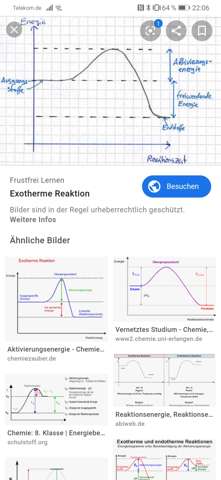
[Chemie] Katalysatoren erhöhen die Reaktionsgeschwindigkeit?
Guten Abend,
leider verstehe ich noch nicht so wirklich, wieso Katalysatoren, und somit eine niedrigere benötigte Aktivierungsenergie dazu führt, dass die Reaktionsgeschwindigkeit sich erhöht. Denn wie wir am Bild sehen können, ist die Reaktion der Edukte zu den Produkten doch nach der gleichen Zeit (x-Achse) abgeschlossen.
Ich freue mich sehr auf eure hilfreichen Erklärungen.