Aktivierungsenergie Reaktion?
Moin.
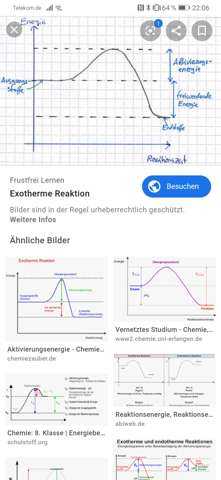
Sry für die Rechtschreibung, ich muss es jedoch so erklären...
Sooo meine frage....ist die aktivierungsenergie der höchste punkt in der Reaktion.... Weil man sieht ja das der höchste teil der Kurve die aktivierungsenergie ist... Jedoch dachte ich dass bei einer exothermen Reaktion mit der aktivierungs eine Energie aktiviert wird welche danach noch stärker ist als die aktivierungsenergie selbst...so hoffe ihr habt meine Frage verstanden....
2 Antworten
Die Aktivierungsenergie ist der kleine Berg am Anfang der Reaktion hier im Beispiel der exothermen Reaktion. Es ist also nicht der höchste Punkt. Der höchste Punkt ist sozusagen der Wert an dem keine weitere Energie mehr zugeführt werden muss damit die Reaktion selbständig abläuft.
Die Aktivierungsengergie ist die Differenz zwischen dem Ausgangsstoff (oder den Ausgangsstoffen) und dem Übergangszustand, dem Gipfel sozusagen. Die muss erst mal aufgebracht werden.
Allerdings wird sie nachher auch wieder frei, wenn der Übergangszustand zu den Produkten weiterreagiert. Wenn die AE z.B. 100 kJ/Mol ist, und die Differenz zwischen Übergangszustand und Edukten 250 kJ/Mol, dann ist die Reaktionsenthalpie 150 kJ/Mol.
Es kann aber auch sein, dass die Aktivierungsengergie viel höher ist, verglichen mit der Reaktionsenthalpie. Bildlich gesprochen musst du über einen Berg, der 1000 kJ/Mol hoch ist, um auf der anderen Seite in ein Tal zu gelangen, das 12 kJ/Mol niedriger ist.