Wieso handelt es sich hierbei um einen Aromat?
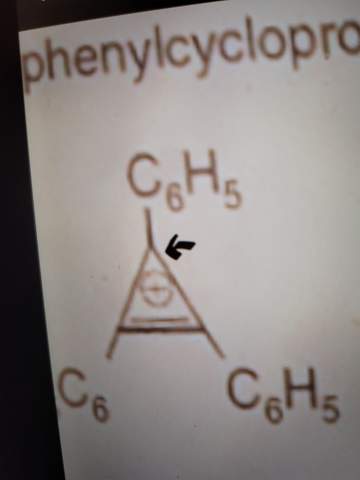
Unsere Begründung in der Schule war, dass die Ladung und die DB "wandern" können.
Aber ein Aromat ist doch nur dann ein Aromat wenn er konjugierte DB hat. Also wenn sich Doppelbindungen und Einfachbindungen abwechseln.
Das geht doch nicht bei 3 C Atomen.
3 Antworten
Unsere Begründung in der Schule war, dass die Ladung und die DB "wandern" können.
Ja, das ist richtig. Man kann drei äquivalente Grenzstrukturen aufschreiben, in denen die positive Ladung an jeweils einem anderen Kohlenstoff landet, und die anderen beiden an der Doppelbindung beteiligt sind.
Allerdings ist die Begründung nicht ausreichend. Denn fürs Cyclopropen-Anion könnte man ja auch drei Grenzstrukturen mit delokalisierter Ladung aufschreiben, aber es ist kein Aromat sondern ein Antiaromat (und deshalb nicht stabil). Entscheidend ist, daß C₃H₃⁺ genau zwei π-Elektronen hat und damit der Hückel-Regel (4n+2, n diesem Fall n=0) gehorcht. Ringsysteme sind also nur mit 2,6,8, … π-Elektronen aromatisch und stabil. Warum das so ist, ist schwierig zu erklären und braucht Quantenmechanik; es stellt sich nämlich heraus, daß es in solchen Ringen immer ein am tiefsten liegendes π-Orbital gibt, aber alle weiteren (außer bei gerader Ringgröße dem allerhöchsten, das man aber nicht braucht) sind entartet, kommen also in energiegleichen Paaren. Mit 4 Elektronen würde man also 2 Elektronen ins tiefte Orbital füllen und dann bleiben nur zwei für das darauffolgende Paar, das aber mit vier Elektronen gefüllt werden will. Halbgefüllte Orbitale sind aber Mist, dann denken sich die Moleküle etwas aus, um dem Unglück zu entkommen.
Benzol C₆H₆ hat 6 π-Elektronen, ist also aromatisch. Cyclooctatetraen C₈H₈ hätte aber 8 und wäre antiaromatisch. In der Realität ist das Molekül nichtplanar gebaut, mit getrennten Einfach- und Doppelbindungen (keine Elektronendelokalisierung). Man kann dem C₈H₈ aber zwei Elektronen zuführen, und das C₈H₈²¯-Ion ist dann ein 10π-System und folglich ein Aromat; es ist planar gebaut und hat teilweise ähnliche Eigenschaften wie Benzol, z.B. bildet es mit Metallen Ocen-Komplexe (das Cyclopentadienid-Anion C₅H₅¯ mit 6π tut das auch).
Es ist per Definition ein Aromat, wenn es der Hückel-Regel gehorcht. Ein cyclisches, planares Molekül mit 4n+2 π-Elektronen ist demnach aromatisch. Für n = 0, 1, 2,...
deine Definition von Aromat ist falsch. Es geht nicht um konjugierte DoBi, sondern die Hückelregel, also 4n+2 delokalisierte Pi-Elektronen, was hier für n=0 erfüllt ist. Also ein Aromat.
m.f.G.
anwesende
Wie gesagt, "konjugierte DoBi" als Voraussetzung ist falsch. Das wird in der Schulchemie (anfangs) gerne als Erklärung genommen, weil man es so am einfachsten für die Schüler "sichtbar" machen kann. Von dieser Regel gibt es auch meines Wissens nur 2 Ausnahmen: Cyclopropenyl und Cyclopentadienyl (Metallocene).
Du hast recht, daß nicht nur die Hückel-Regel gelten muß, sondern mehrere Voraussetzungen nötig sind:
-Cyclisch
-delokalisierte Pi-Elektronen (das sind üblicherweise deine konjugierten DoBi, aber eben nicht nur)
-Hückel-Regel
m.f.G.
anwesende
Danke, Aber ich habe in der Schule gelernt, dass ein aromat mehrere Kriterien erfüllen muss. Ja , die Hückelregel gehört dazu, aber eben auch die konjugierten doppelbindungen