Wie ist eine Aminosäure besser wasserlöslich?
Wenn sie als Zwitterion (mit 2 Ladungen vorliegt) oder wenn sie als Anion/Kation vorliegt?
und warum?
2 Antworten
Aminosäure sind passabel wasserlöslich als Zwitterion (also bei den meisten Aminosäuren rund um den Neutral-pH), und noch besser wasserlöslich in protonierter oder deprotonierter Form (bei den meisten Aminosäuren entspricht das stark saurem bzw. basischem pH). Ich nehme an, daß die mittelprächtige Wasserlöslichkeit der Zwitterionen darauf beruht, daß sie (wie Ionen) eine hohe Gitterenergie aufweisen (der feste Zustand ist schön stabil), aber eine geringere Hydratisierungenergie als echte Ionen. Daraus resultiert im Endeffekt eine nicht so tolle Energiebilanz für den Lösevorgang und entsprechend reduzierte Löslichkeit.
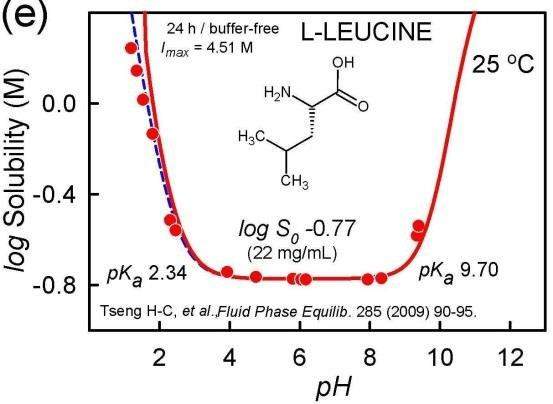
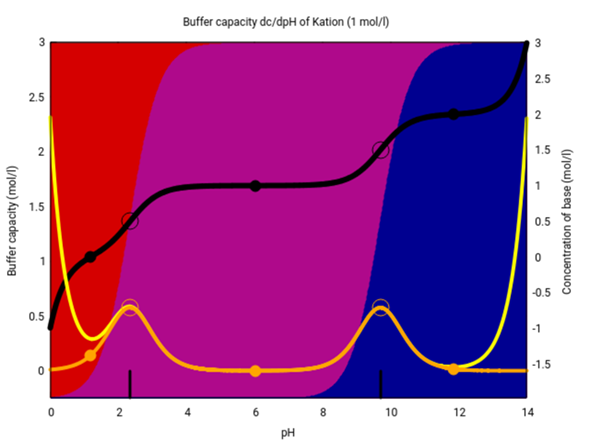
Da es hier eine andere Antwort gibt (die meiner Meinung nach purer Quatsch ist), gebe ich einen Treffer im Web als Quelle an: https://www.toppr.com/ask/question/amino-acids-are-least-soluble/ Das ist zugegebenermaßen keine wirklich zitierfähige Quelle, also hier noch eine Abbildung aus einem Paper: Das kannst Du vergleichen mit der Spezies-Zusammensetzung je nach pH-Wert (Kation rot, Zwitterion violett, Anion blau), die ich aus denselben pKₐ-Werten berechne.
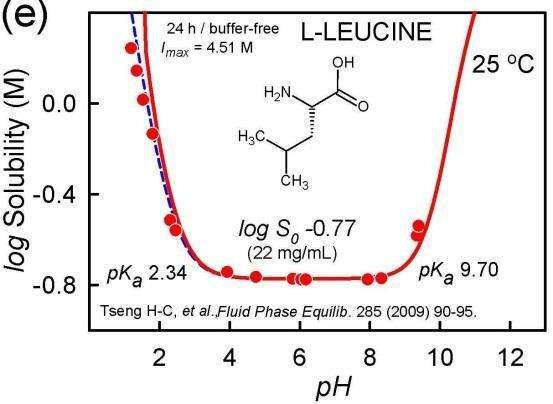
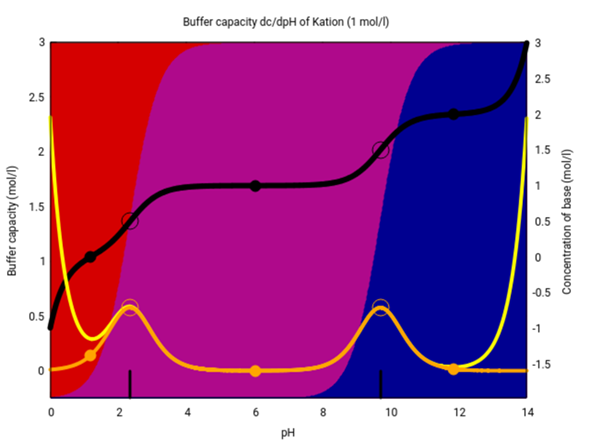
Das Zwitterion dominiert also grob zwischen pH 2 und 10, und genau das ist auch er Bereich der geringeren Löslichkeit. Du siehst aber auch daß der Unterschied in der Löslichkeit nicht extrem ist, weniger als ein Faktor 10.
Aminosäuren als Zwitterion sind besser wasserlöslich. als wenn sie als Anion/Kation vorliegen. Dies liegt daran, dass Zwitterionen sowohl positive als auch negative Ladungen haben, die in Wasser gelöst werden können, während Anionen oder Kationen nur eine Art von Ladung haben und daher nicht so leicht in Wasser gelöst werden können.
Sehe ich genauso und habe daher sogar eine Graphik aufgetrieben. Hatte da ChatGPT einen schlechten Tag?
Das Gegenteil ist der Fall.