pH-Wert berechnen ohne pKs/pKb-Wert?
Die a) habe ich verstanden pH-Wert ist -3, wie berechne ich den Wert z.B. bei der b) ohne pKs-Wert und wie geht das bei c)-e)?
Für Hilfe wäre ich sehr dankbar!
1 Antwort

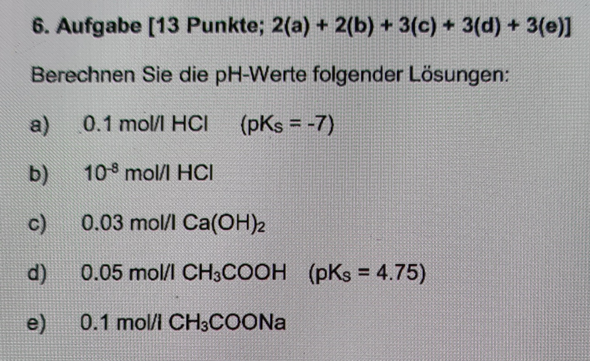
a) Als sehr starke Säure kann man bei Salzsäure von vollständiger Protolyse ausgehen. Deshalb ist die Oxoniumkonzentration gleich der Säurekonzentration.
c(H3O⁺) = c(HCl) = 0,1 mol/L
pH = -log(c(H3O⁺)) = 1
b) Hier gilt im Prinzip dasselbe wie bei a), nur muss bei dieser extremen Verdünnung die Autoprotolyse des Wassers berücksichtigt werden. Wenn man diese außer Acht ließe, ergäbe sich bei der obigen Rechnung ein pH-Wert von 8. Das ist im basischen Bereich und natürlich Unsinn, denn eine Säure wird durch Verdünnung natürlich nicht basisch. Für die Schulzwecke rechnet man einfach:
pH = -log(c(H3O⁺)) = -log(10⁻⁸ + 10⁻⁷) = 6,96
c) 0,03 mol/L Ca(OH)2 liefern bei vollständiger Dissoziation 0,06 mol/L OH⁻-Ionen.
pOH = -log(OH⁻) = -log(0.06) = 1,22
pH = 14 - pOH = 12,78
d) pH = 1/2(pKs - log(c)) = 1/2(4,75 - log(0,05)) = 3,03
e) Das Acetation reagiert basisch gemäß
Ac⁻ + H2O <--> HAc + OH⁻
pOH = 1/2(pKB - (cB))
pOH = 5,125
pH = 14 - 5,125 = 8,9