pH-Wert einer Natriumhydrogencarbonat-Lösung berechnen?
Wie berechne ich den pH-Wert einer 0,01 M NaHCO3-Lösung? Brauche ich dafür den pKs oder pKb Wert? Und brauche ich den Wert von HCO3- oder auch den von CO32-?
1 Antwort
Hydrogencarbonat ist ein Ampholyt,kann also sowohl als Säure als auch als Base reagieren:
HCO₃⁻ + H₂O ⟶ CO₃²⁻ + H₃O⁺
HCO₃⁻ + H₂O ⟶ „H₂CO₃“ + OH- ⟶ CO₂ + OH⁻ + H₂O
Die erste Reaktion ist die zweite Protolysestufe der Kohlensäure, die zweite ist im wesentlichen die Umkehrung der ersten Protolysestufe. Daher brauchst Du i.a. beide Säurekonstanten (pK₁=6.36, pK₂=10.33), um den pH einer solchen Lösung zu berechnen. Im Detail sieht das so aus:
- Wenn Du so tätest, als ob HCO₃⁻ nur eine Säure wäre (also nur die erste Reaktion), dann bekämst Du pH=½(pK₂−lg(c))=6.16
- Wenn Du so tätest, als ob HCO₃⁻ nur eine Base wäre (zweite Reaktion), dann bekämst Du pH=7+½(pK₁+lg(c))=9.18
- Die beliebte Näherungsformel für Ampholyte ergibt pH≈½(pK₁+pK₂)=8.35. Eine genaue Rechnung liefert 8.34, also ist die Näherungsformel gut.
Beachte, daß die Näherungsformel einen konzentrationsunabhängigen pH voraussagt (es ist ja nur eine billige Näherung). Es gibt auch eine etwas aufgemotzte Version dieser Formel, pH=−lg½(K₁K₂c/(K₁+c)), die in diesem Fall dasselbe Resultat liefert, aber auch nicht richtig beschreiben kann, daß der pH jeder Lösung mit zunehmender Verdünnung gegen 7 strebt; daher ist sie selten ein Gewinn (eigentlich nur, wenn pK₁ ungewöhnlich klein ist).
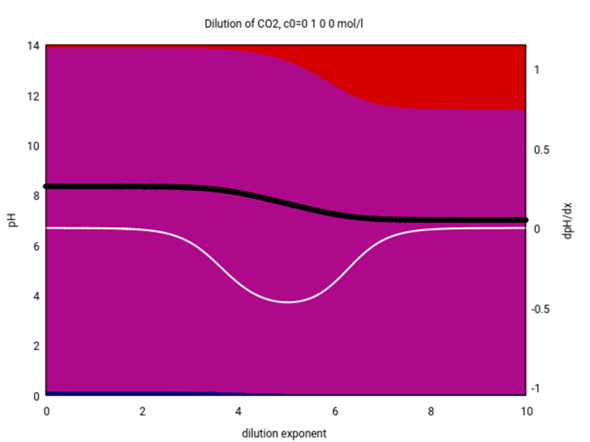
Hier siehst Du es genauer. Die Abszisse gibt die Konzentration logarithmisch an (c=10⁻ˣ mol/l), die schwarze Kurve ist der pH und die weiße die erste Ableitung davon. Man sieht, daß der pH bei Konzentrationen über 10⁻³ mol/l wirklich konstant ist und 8.34 beträgt. Der meiste Kohlenstoff liegt als unverändert als Hydrogencarbonat vor (violetter Hintergrund), bei hohen Konzentrationen gibt es auch eine winzige Menge Carbonat (blau), und außerdem gibt es einen kleinen Anteil freies CO₂ (rot), der bei Verdünnung zunimmt.