Innere Energie Formel (Wärmelehre)?
Da gibt es zwei Formeln? Was von denen muss man wann nehmen? Oder sind das die Gleichen? Oder ist das 1. U allgemein und das 2. das, was bei der Reaktion dazu- oder wegkommt?
Und Frage am Rande, bei den Gasen ist W anscheinend die Volumenarbeit. Was soll man für Nichtgase verwenden? Die normale Arbeit F*s?
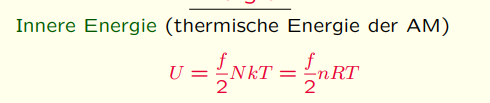

3 Antworten

Da gibt es zwei Formeln?
So ist es. Die ursprüngliche Formel der klassischen Thermodynamik ist
ΔU = Q + W
( es hat sich zwar die Unsitte verbreitet, ΔQ und ΔW zu schreiben, was aber Blösdinn ist, denn Q und W sind absolute Prozessgrößen und keine Veränderungen von Zustandsgrößen wie ΔU.
Mit diese Formel, die 1845 von J. R. Mayer als 1. Hauotsatz der Themrodynamik formuliert wurde, kann man tatsächlich rechnen und wirst du in nächster Zeit auch rechnen müssen.
Später, so gegen Ende des 19. Jahrhunderts leitete Ludwig Boltzmann auf der Basis der statistischen Mechanik von Gibbs die Größen der Thermodynamik basierend auf dem Teilchenmodell auch statistisch her. Das ist die Formel:
U = f/2 * N * k * T
Ich rätsle schon seit Jahren darüber, warum in machen Fächern dermaßen intensiv darauf rumgeritten wird. Das war zwar eine große Leistung von Boltzmann, den ich insbesondere als Enfant Terrible des damaligen Wissenschaftsbetriebes sehr schätze, aber praktisch kann man damit gar nichts anfangen, außer gehobene Bildung vorzutäuschen, wenn man die Formel kennt. In der späteren Praxis eines Chemikers, Physikers oder Ingenieurs außerhalb der Unität spielt diese Formel keine Rolle mehr. Da wird mit der ersten Formel gerechnet bzw. mit deren Weiterentwicklung zur Enthalpie.
Und Frage am Rande, bei den Gasen ist W anscheinend die Volumenarbeit. Was soll man für Nichtgase verwenden? Die normale Arbeit F*s?
Bei Flüssigkeiten und Festkörpern gibt es zwar auch eine Volumenausdehnung mit zunehmender Temperatur, die spielt aber fast keine Rolle, weil sie so gerinmg ist, und wird deshalb regelmäßig vernachlässigt. Mit hinreichender Genauigkeit kann man die Änderung der innere Energie ausschließlich über die ausgetauschte Wärme berechnen.

ΔU = ΔQ + ΔW
Hier geht es um die innere Energie eines thermodynamischen Systems als ganzes. Das kann beispielsweise ein gasgefüllter Behälter sein. Die Formel besagt: Die Änderung der inneren Energie eines Systems ist gleich der Summe aus der dem System zugeführten Wärmemenge ΔQ und an dem System verrichteten Arbeit ΔW. Bei Gasen kann diese Arbeit als Volumenarbeit erfolgen. Es gilt dann ΔW = pΔV. Auch kann durch Druckänderung am System Arbeit verrichtet werden.
U = f/2 * N * kBT
Hier wird die innere Energie von Teilchen in einem System, welches sich in einem thermodynamischen Gleichgewicht befindet, beschrieben. Dabei steht f für die Freiheitsgrade des Teilchens. Für N = NA, also wenn N = 6,02 * 10²³ (ein mol) ist, wird daraus:
U = f/2 * RT
Es wird dann aus der Bolzmann-Konstante die allgemeine Gaskonstante R.

Stelle dir eine Gefäß mit einem Gas vor, was mit einem Stempel versehen. Führst Du nun Energie zu dehnt sich das Gas aus und drückt den Stempel nach oben (W). Würdest Du nun ein Metallblock haben der de facto nicht so ausdehnt, dafür aber eben immer wärmer (Q) wird. Bei der inneren Energie U geht man davon aus, dass diese im System verbleibt.
Der erste Hauptsatz der Thermodynamik besagt, dass die Energie eines abgeschlossenen Systems konstant ist. Das bedeutet, dass die Energie eines Systems nicht verloren gehen oder erzeugt werden kann, sondern nur in andere Formen umgewandelt werden kann.