Frage zur Beurteilung der Säurestärke?
Hat Iod einen stärkeren +M- Effekt als Chlor weil es deformierbarer ist?
Und ist das die Erklärung warum HCLO3 eine stärkere Säure ist? Oder hat das mehr was mit der Kernladung und dem Unterschied in der Elektronegativität zu tun?
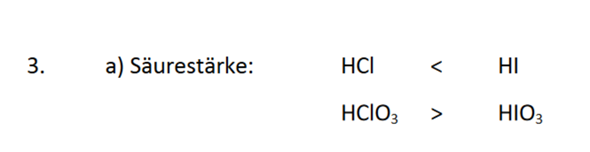
2 Antworten

Grund bei 1.: Iod hat einen größeren Atomdurchmesser, deswegen kann das Proton besser abgespalten werden.
Grund bei 2.: Chlor ist elektronegativer als Iod.
Der Unterschied zwischen den beiden ist dass bei 1. das Wasserstoff direkt am Halogen sitzt, bei 2. das Wasserstoff bei beiden Säuren an einem Sauerstoff, deswegen zählt hier dann die Elektronegativität des Halogens.
Schau dir vllt mal nochmal die Valenzstrichformeln von HClO4 und HIO4 an in dem Kontext.

Das Anion wird ja sowohl bei HClO3 als auch HIO3 gleichermaßen stabilisiert, da für die Mesomerie nur die Sauerstoffe von Bedeutung sind. Diese Info ist also nicht wichtig für den Vergleich der Säurestärke untereinander.

Iod ist deutlich größer als Chlor und somit ist die Anziehungskraft entsprechend kleiner. Dazu kommt dass das Ion bzw die Ladung durch die große Oberfläche verteilt/stabilisiert ist. Folglich kann das Proton einfacher abgegeben werden. Gleiches gilt auch für die iodsäure und chlorsäure. Ein besser stabilisiertes Ion ist hier für Azidität ausschlaggebend
Wichtig ist auch zu erwähnen, dass das Anion besser stabilisiert ist. Das ist meines Erachtens wichtiger als der EN wert