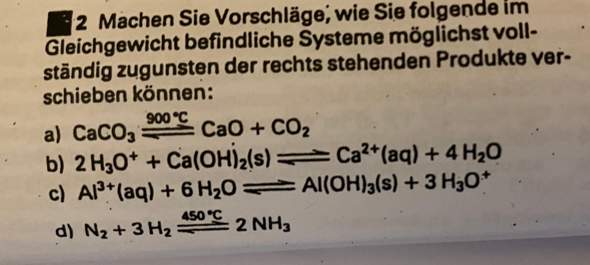
chemie Gleichgewicht?
Hi, wie soll ich diese Aufgabe angehen? ich verstehe die nicht ganz… So ein Vorschlag was ich bei der a hinschreiben soll, würde mir helfen.. ich danke im voraus!
2 Antworten

- Das CO₂ wegblasen und die Temperatur möglichst hoch wählen
- Ausreichend sauer machen, also viel H₃O⁺ zugeben
- Das H₃O⁺ mit einer Base wegfangen, z.B. NH₃, Urotropin, von mir aus NaOH
- Bei hohem Druck arbeiten
Natürlich sind auch andere Methoden der Gleichgewichtsverschiebung möglich, aber die genannten bieten sich fast von selbst an und sind auch praxistauglich.

Die Exothermizität von (4) legt nahe, daß man die Reaktion bei niedriger Temperatur versuchen sollte. Leider ist sie dann aber schnaaaarchlangsam, deshalb muß man eine Kompromißtemperatur wählen, bei der die Reaktionsgeschwindigkeit schnell genug ist, aber das Gleichgewicht noch hinreichend auf der Produktseite liegt. Wer einen Katalysator findet, der die Reaktion bei Raumtemperatur erlaubt, der wird berühmt (ja, Bakterien können das, aber leider hilft das nicht viel).
Bei (1) verschieben hohe Temperatur (wegen Entropiegewinns durch Gasbildung) und Abtransport des CO₂ (geringe Konzentration im MWG) das Gleichgewicht zur Produktseite.

kannst du mir noch analog erklären, wie sich das Gleichgewicht bei den anderen Reaktionen bei den Vorschlägen verschieben ?


was meint man eigentlich mit zugunsten der rechts stehenden Produkte verschrieben?


Entfernen eines Produktes, zB gut Ventillieren, damit Gase abdampfen. Dinge ausfällen, pH neutral halten, oder im Gegenteil zu freigesetzten Ionen.
Oder wenn das Volumen bei Reaktion sinkt, Druck aufbauen.
bei 4 ist das ja eine exotherme Reaktion, das habe ich vergessen anzumerken.. also wenn man bei 1) das CO2 wegmacht und die Temperatur hoch wählt dann verschiebt sich das gleichgewicht zu den Edukten (nach links)?