Atome mit bis zu drei Elektronen, Moleküle?
Hallo,
können Atome mit bis zu drei Elektronen überhaupt Moleküle bilden?
Die haben ja an sich nur drei Moleküle und könnten wenn nur bis zu drei Elektronenpaare bilden, was insgesamt dann sechs Elektronen und nicht die acht ergeben würden welche bei der angestrebten Edelgaskonfiguration erreicht wären.
Bzw. wäre es dann nicht trotzdem immer noch energetisch ungünstiger/instabiler im Vergleich zum Erreichen der Edelgaskonfiguration?
3 Antworten
Die Elemente, die nur 3 oder weniger Außenelektronen haben stehen eher links im Periodensystem. Dabei handelt es sich um Metalle, die dementsprechend oft als Kation in Salzen fungieren. Da haben sie ihre bis zu 3 Valenzelektronen abgegeben und so ihren Edelgaszustand erreicht.
Beim H-Atom hast du die Besonderheit, dass es links in Periodensystem bei den Metallen steht, obwohl es ein Nichtmetall ist. Es hat aber auch die Besonderheit, dass es nur eine Schale hat, und die erste, unterste Schale nur 2 Elektronen aufnehmen kann. Das Helium, direkt nach Wasserstoff, hat ja bereits Edelgaskonfiguration. Die Elemente der 1. Periode benötigen also nur 2 Elektronen in der Außenschale, um den Edelgaszustand zu erreichen.
Und Molekülverbindungen mit Wasserstoff kennst du sicherlich einige.
Ich nehm an du sprichst von Bor bzw der Gruppe 13 oder? Die hat eine Sonderstellung im PSE, vor allem Bor. Weil es zwar einigermaßen elektronegativ ist (nicht wenig genug um ein Metall zu sein, sozusagen), aber trotzdem Elektronenmangel hat, wie du schon richtig erkannt hast.
Deswegen hat es eine sehr besondere Chemie (es gibt ganze Arbeitsgruppen an Unis, die sich fast nur mit Bor beschäftigen). Ein Beispiel: Es gibt ja OH2, NH3, CH4, die allesamt stabil sind. Man sollte also meinen, es gäbe auch ein (stabiles) BH3. Aber das gibt es nicht. Das liegt daran, dass im Gegensatz zu den anderen Bor nicht elektronegativer als H ist. Das heißt, das H im BH3 ist hydridisch (negativ polarisiert), was an sich schon unvorteilhaft ist. Dazu kommt, dass 3 Hs ja gar nicht das Oktett für Bor erfüllen, damit hat es ja dann nur 6 Elektronen statt der gewünschten 8. Deswegen dimerisiert BH3 zu B2H6 und bildet 3 Zentren 2 Elektronen Bindungen mit Hs als Brücke.
Der Elektronenmangel von Bor in Kombination mit seiner doch recht hohen EN (im Vergleich zu Al, Ga, Erdalkalimetallen, etc) führt dazu dass man ziemlich abgefahrene Verbindungen damit machen kann. Kleines Beispiel aus einer Vorlesung:
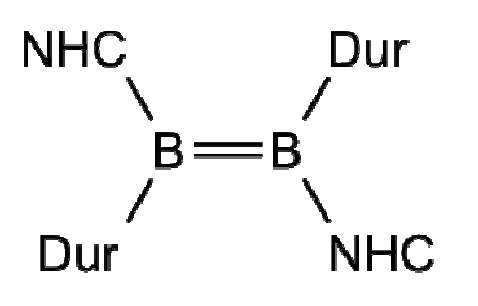
Über Borchemie kann man ganze Abhandlungen verfassen, deswegen kann ich das nicht so weit ausführen. Aber du kannst gern noch fragen, wenn du was bestimmtes wissen willst.
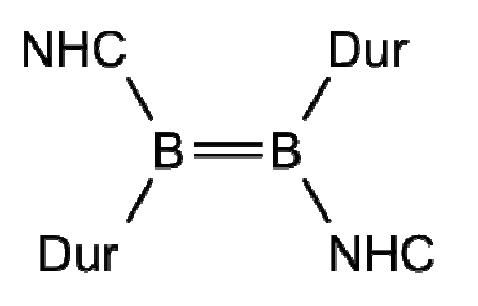
Man sollte vielleicht noch erwähnen, dass die Elemente, die Elektronenmangel haben (also Alkali- und Erdalkalimetalle, sowie Gruppe 13) allesamt mit Nichtmetallen vorzugsweise Salze bilden. Nur Bor macht das eben nicht aus genannten Gründen. z.b. ist AlF3 ein Salz mit Schmelzpunkt von über 1000 °C, aber BF3 hat einen Schmelzpunkt von -120 °C (also offensichtlich kein Salz sondern ein richtiges Molekül)
Das H-Atom hat ein Elektron. H2 ist ein Molekül aus 2 H-Atomen. Ein einfacheres Molekül gibt es nicht. Bitte vorher etwas mehr nachdenken!
Etwas mehr nachdenken?
Bitte lies doch meine Frage genauer.
Ein Wasserstoffatom besitzt nur die eine Atomhülle welche bei zwei Valenzelektronen schon ihre Edelgaskonfiguration erreicht hat.
Ein Brom Atom hat nur drei Elektronen in seiner Außenschale und könnte auf diesem Weg doch die Edelgaskonfiguration, welche das Wasserstoffatom hingegen so erreichen kann, per se nicht erreichen.
Zitat: "können Atome mit bis zu drei Atome überhaupt Moleküle bilden?" Was soll denn damit gemeint sein?
Lies dir die Fragestellung jetzt mal nochmal durch. Das war ein Fehler, ich meinte aber Elektronen wie du selbst auch schon meintest. Ich habe dies korrigiert.
Trotzdem steht der Punkt, dass doch Atome mit bis zu drei Elektronen nicht die angestrebte Edelgaskonfiguration erreichen können da diese eben nur drei Elektronenpaare insgesamt binden können dies doch somit energetisch instabiler wäre als die angestrebte Edelgaskonfiguration.
Auch 2 Elektronen in der1. Außenhülle stellt eine Edelgaskonfiguration dar. Dies entspricht dem Edelgas Helium.
Ja?
Das Gleiche meinte ich doch auch zu deiner eigentlichen Antwort.
Wenn ein Atom mind. drei Valenzelektronen besitzt, ist es doch schon vorausgesetzt, dass es sich nicht mehr im Rahmen der ersten Schale handelt.
Die Rede ist beispielsweise von Atomen wie z.B. Brom mit drei Elektronen in der zweiten Elektronenhülle.
Und bei einer Atombindung (Molekülen) können keine Elektronen abgegeben werden. Dies ist nur der Fall bei Ionenbindungen.
Rhenia, hast du Lust weiter zu machen? Mich nervt es inzwischen.
Piguin8229870 schau mal unter https://de.wikipedia.org/wiki/Bor
Da werden Borverbindungen dargestellt. Auf diese Idee hättest du auch selber kommen können. Du stellst dich an wia Schwaibal wenns blitzt.
Und deshalb dimerisiert bspw. BH3 zum Diboran, so kann es nämlich doch den Oktettzustand erreichen. Ein Elektronensextett ist aber erst einmal kein größeres Problem, solange keine ungepaarten Elektronen vorliegen. Borsäure ist schließlich auch stabil, sie reagiert nur recht gut als Lewis-Säure, da es sich um eine Elektronenmangelverbindung handelt.
Nur so nebenbei: wer hat euch beide gezwungen zu antworten? Ihr wart doch auch kurz weg, das heißt ihr hättet nicht wieder kommen müssen. Das ist nicht mega respektvoll um es ganz ehrlich zu sagen.
Und wenn euch eurer Wochenende doch so kostbar ist, verschwendet es doch nicht solch einer Person wie mir etwas zu erklären - das wäre ja sehr perplex.
Trotzdem danke ich für die Hilfe.
Und nur weil es auf Wikipedia solch eine Verbindung dargestellt wird, heißt es nicht, dass diese auch erklärt wird. Sachen zu sehen ist was anderes als die Materie dahinter zu verstehen.
Tausend Dank!