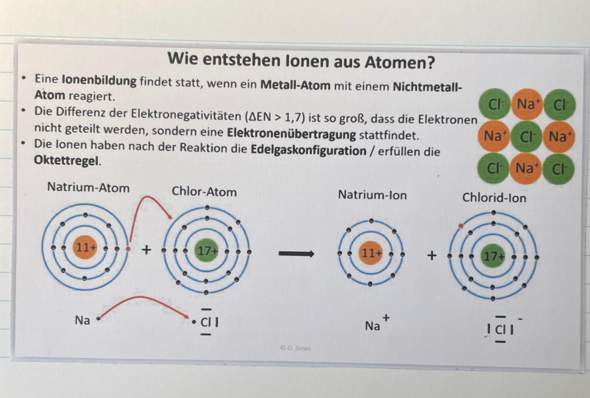
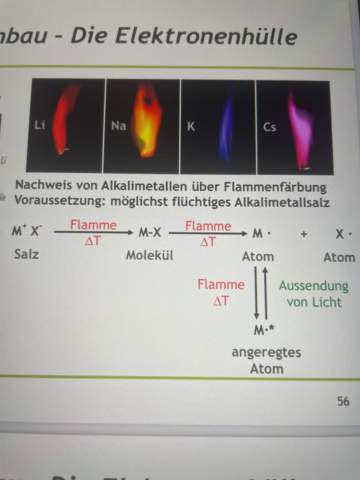
Hallo, ich hoffe hier treiben sich einige Chemiker rum, die mir helfen können. Und zwar hatte ich mir Kupfer(II)-sulfat Pentahydrat gekauft und damit ein bisschen rumexperimentiert, einfach aus Spaß, zB Flammenfärbung und so.
Dann habe ich in eine Kupersulfatlösung noch Natriumchlorid reingegeben, die anfangs blaue Lösung wird dann immer grüner bis sie irgendwann richtig grün ist. Meines Wissens nach heißt das ja, dass Cu1+ Ionen vorliegen. Wenn man den Feststoff, der sich nachher absetzt, nachdem das Wasser verdunstet ist, in eine Flamme hält, färbt sich diese türkis bis blau.
Anbei findet ihr Fotos dem Zeug, als es angefangen hat, etwas zu kristallisieren. Allerdings habe ich auch Kristalle, die typisch wie Natriumchlorid- Kristalle aussehen, gefunden. Also halt diese typische farblose quadratische Form. Das würde ja dafür sprechen, dass das Natriumchlorid gar nicht mitreagiert hat. Die grüne Färbung entsteht ja aber bei Zugabe von NaCl.
Ich bin mir auf jeden Fall jetzt nicht sicher, was für einen Stoff ich da vorliegen habe und hoffe, jemand kann mir das sagen und mir auch erklären, was warum reagiert. Vielen Lieben Dank :))