Warum hat Salpetersäure eine positive und negative Ladung?
Als ich die Strukturformel für die Salpetersäure gezeichnet habe hatte ich zwei doppelbindungen zum Sauerstoff gebildet und eine einfachbindung zum dritten Sauerstoff im Buch wird es mir aber anders angezeigt siehe Bild.
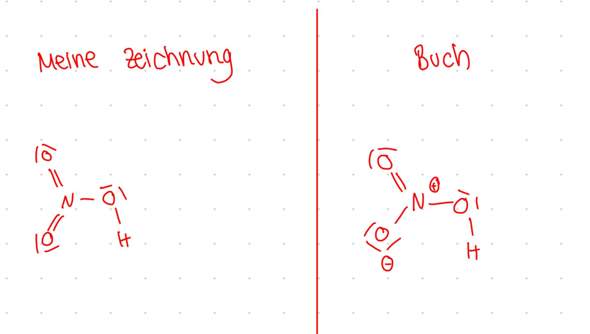
2 Antworten

Deine Zeichnung ist falsch, die im Buch ist richtig.
Der Grund ist die Oktettregel, die im Fall von N (und C,O,F) strikt gilt: Diese Atome wollen exakt 8 Elektronen haben; weniger ist ungewöhnlich und meist sehr instabil, mehr geht auf keinen Fall. Bei Dir hat der Sticki jedoch fünf Elektronenpaare also 10 Elektronen, das ist unmöglich (bei P wäre es möglich, weil da die Oktettregel in einer abgemilderten Form gilt, der P will 8 oder mehr Elektronen).
Also muß man die insgesamt 12 Elektronenpaare des HNO₃-Moleküls so auf bindende und nichtbindende Paare verteilen, daß N und O jeweils genau 8 Elektronen bekommen. Dabei entstehen Formalladungen, denn wenn man die bindenden Elektronenpaare jeweils in der Mitte zerteilt und dann die Elektronen pro Atom zählt, dann hat der Stickstoff 4 Elektronen (eines weniger als im Atom), und ein Sauerstoff 7 (eines mehr als im Atom), und diese Formalladungen werden in der Formel angeschrieben.
Formalladungen sind aber nur eine Buchhaltungsgröße, Du darfst sie nicht mit den echten und meßbaren Partialladungen verwechseln. In Deinem Fall haben die Formalladungen dasselbe Vorzeichen wie die echten Partialladungen (δ⁺ am N), aber das muß nicht so sein — im H₃O⁺ hat der Sauerstoff eine psotive Formalladung, aber wegen der Elektronegativitätsdifferenz zum H muß er auf jeden Fall eine negative Partialladung haben.

Das ist der organische Rest. Das Anion ist .... logischerweise negativ geladen, also das planare das NO3- Und wie gesagt, das was dich irritiert ist der organische Rest. Durch die organische Esterdarstellung