Stabiler Zustand des Schwefelatoms in Schwefelsäure?
Hi!
Ich hab folgende Aufgabe von meiner Chemie Lehrerin bekommen:
Begründen Sie mithilfe der Elektronenkonfiguration, dass die Schwefelatome in Schwefelsäure und in schwefliger Säure jeweils stabile Zustände besitzen.
Ich hab dann, um die Aufgabe zu lösen, die Strukturformel von Schwefelsäure aufgezeichnet und festgestellt, dass Schwefel in der Verbindung dann insgesamt 12 Außenelektronen hat. Ich wollte das dann in die Elektronenkonfiguration übertragen und bin auf folgende gekommen: 16S (Ne) 3s2 3p6 3d4. Passt das so? Und wieso ist das Schwefelatome dann stabil? Das 3d-Orbital ist doch weder halb- noch vollbesetzte, oder?
2 Antworten
Das mit den 12 Außenelektronen stimmt nicht so ganz. Schwefelsäure ist da ein besonderer Fall, da die Bindungsstruktur, die man so lernt, eigentlich nicht richtig ist. So wird sie ja für gewöhnlich gezeichnet:
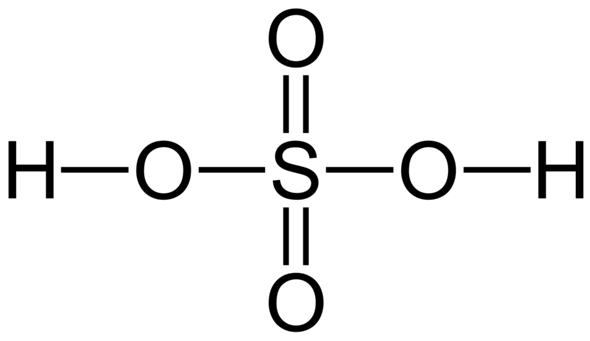
Hier hätte S jetzt 6 kovalente Bindungen mit insgesamt 12 Elektronen um sich herum. Das kann aber eigentlich nicht richtig sein. Denn erstens verletzt das die Oktettregel und zweitens hat Schwefel nur 4 Orbitale zur Verfügung mit denen es kovalente Bindungen ausbilden kann (d-Orbitale sind da nicht dran beteiligt). Hier stimmt also was nicht.
Eine sinnvollere Zeichnung ist diese hier:
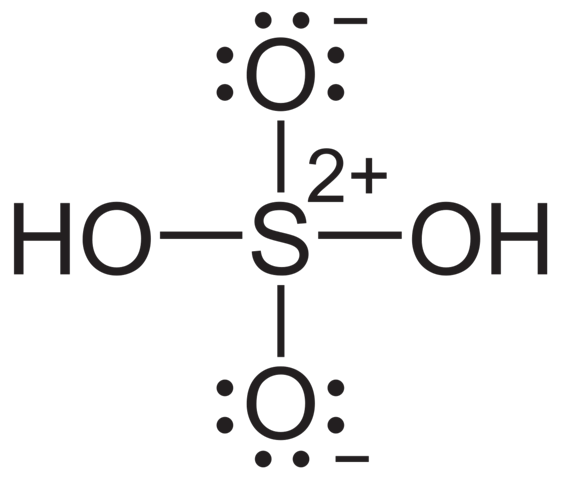
Hier hat Schwefel sein Oktett und auch nicht zu viele Bindungen, was die Stabilität erklärt. Allerdings sind hier jetzt ganz schön viele Ladungen drauf, was ja eigentlich schlecht ist. Die reale Bindungssituation dürfte also irgendwo dazwischen liegen, auch im Hinblick auf Mehrzentrenbindungen über Orbitale von S und mehreren O. Das MO-Diagramm dazu ist aber sehr kompliziert und bringt einem in den allermeisten Fällen auch nichts, weil eine so detaillierte Betrachtung höchstens für Theoretiker interessant ist. Die (bindungstechnisch) sinnvollere Zeichnung ist aber trotzdem die zweite, da du hier die jeweils zweite Bindung der Doppelbindungen ionisch vorliegen hast und keine Oktettüberschreitung zur Erklärung brauchst.
Auf jeden Fall kann man aber sagen, dass eine Elektronenkonfiguration bei der d-Orbitale gefüllt werden, nicht richtig sein kann. Die d-Orbitale sind bei Hauptgruppenelementen energetisch viel zu unvorteilhaft als dass die an Bindungen beteiligt wären. Das hatte man früher zwar mal angenommen, wurde aber durch Berechnungen widerlegt.
Es lässt sich sagen, dass die Schwefelatome in Schwefelsäure und schwefliger Säure stabile Zustände besitzen, da sie durch die Bildung von kovalenten Bindungen mit Sauerstoffatomen und die Dissoziation in Wasser eine vollständige äußere Elektronenschale erreichen. Die chemischen Eigenschaften dieser Säuren unterstützen zusätzlich ihre Stabilität.