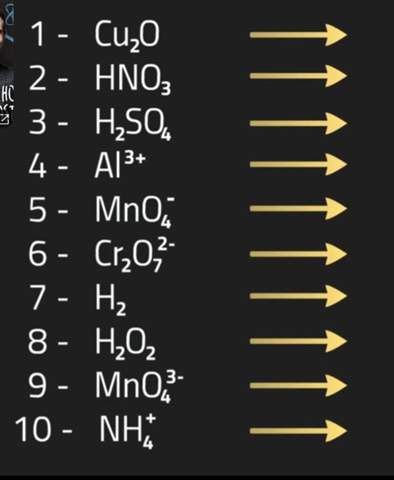
Oxidationszahlen mit Ladung?
Hallo, ich wollte mal nachfragen wie man die Oxidationzahl bei Verbindungen die eine bestimmte Ladung haben (z.B. nr. 5,6,9,10) herausfindet und ob man bei denen etwas Besonderes beachten muss?
2 Antworten
Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Chemie, Atom, Chemieunterricht
Im Prinzip funktioniert das nicht anders als bei ungeladenen Verbindungen. Bekanntlich ist ja die Summe aller Oxidationszahlen gleich der Gesamtladung des Teilchens.
- Wenn Du die Oxidationszahlen aller Atome bis auf eines kennst, dann kannst Du die fehlende leicht aus der Summenbeziehung bekommen. Beispiel Cr₂O₇²⁻, für den Sauerstoff kann man −II schätzen, dann liefern die 7 O-Atom insgesamt −14 an Ladung, davon bleiben nur zwei als Ionenladung übrig, also müssen die beiden Cr-Atome insgesamt +12 beitragen, also ist es Cr⁺ⱽᴵ.
- Aus der Strukturformel kriegst Du die Oxidationszahl wie immer durch Aufteilen der Elektronen (bindende und nichtbindende) nach Elektronegativität.
- Wenn das alles nichts hilft, dann mußt Du wie immer tricksen und z.B. Stammverbindungen heranziehen. Im [PMo₁₂O₄₀]³⁻ kommst Du im Prinzip nur weiter, wenn Du weißt, daß es sich um ein Phosphat-Verbindung handelt, die sich also von der Phosphorsäure H₃P⁺ⱽO₄ herleitet. Dann kommst Du mit üblichen Regeln auf Mo⁺ⱽᴵ.
Woher ich das weiß:Studium / Ausbildung – Chemiestudium mit Diss über Quantenchemie und Thermodynamik
Vielen Dank für die Antwort, jetzt habe ich es auch verstanden 😊
Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Chemie, Atom, Chemieunterricht
Die Summe der Oxidationszahlen muss der Ladung entsprechen. Also genauso wie bei den neutralen auch.