Kann mir jmd den Vorgang beim Lösen eines Salzes im Wasser beschreiben?
Mit den Kationen und Anionen usw....
4 Antworten
Löst man einen Ionenkristall in Wasser, so findet ein Energieumsatz statt, der durch zwei Merkmale gekennzeichnet ist: es wird Energie verbraucht, um die Gitterenergie zu überwinden, andererseits wird bei der Hydratation der Ionen Energie gewonnen. Bei einer Hydratation werden die Ionen von Wassermolekülen umhüllt.
Ist die Hydrationsenergie gleich groß oder größer als die Gitterenergie des Salzes, bezeichnet man ein Salz als gut löslich. Bei Salzen, bei denen die Hydrationsenergie deutlich größer als die Gitterenergie ist, tritt beim Lösen eine Erwärmung des Salz-Wasser-Gemischs ein (Lösungswärme).
Es gibt Salze, da kühlt sich beim Lösen von diesen die Lösung ab. Diese Abkühlung beruht darauf, dass die Hydrationsenergie die zum Auflösen des Salzes nötig ist, niedriger als die Gitterenergie ist und dass die zusätzlich noch benötigte Energie aus der Wärmeenergie des Wassers entnommen wird.
Ist die Gitterenergie wesentlich größer als die Hydrationsenergie, läuft der Lösungsvorgang nicht ab: der betreffende Stoff ist in Wasser unlöslich.
Merke also:
Hydratationsenergie > Gitterenergie Erwärmung und gute Löslichkeit
Hydratationsenergie < Gitterenergie Abkühlung bzw. Unlöslichkeit
Hydratationsenergie ≈ Gitterenergie isothermer Lösungsvorgang
Das Lösemittel Wasser ist sehr polar und protisch. Die Ionenbindung wird "aufgebrochen" und es entstehen:
1) Kationen: z.Teil mehrschichtige Aquokomplexe
2) Anionen: Diese werden auch aufgrund elektrostatischer Wechselwirkungen angezogen --> Wasserstoffbrückenbindungen
Meist werden die Anionen dabei etwas deformiert
Viele Salze lösen sich gut, da die Wassermoleküle die Ionen und deren Ladung gut stabilisieren können. Manchmal wird beim Lösevorgang sogar Energie in Form von Wärme frei,. man bezeichnet sie als Hydratationsenthalpie..
Natürlich gibt es auch schwer lösliche Salze (CaSO4; AgI; Hg2Cl2 etc.)
Das angehängte Bild illustriert das Ganze.. ;)
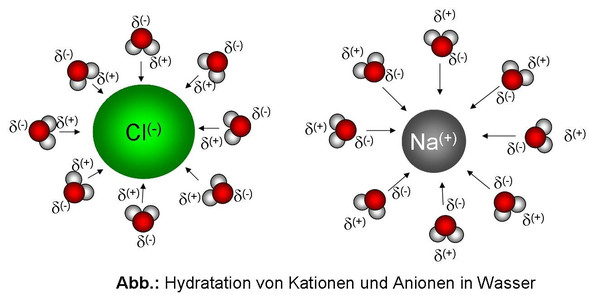
Ich nehme mal als Beispiel Natriumchlorid, also Kochsalz. Der Lösungsvorgang von Kochsalz beruht auf Dipol-/Ionen-Wechselwirkungen. Wasser besteht ja bekanntlich aus Dipol-Molekülen. Die Wasser-Moleküle sind gewinkelt und der Sauerstoff trägt eine negative Teilladung (Partialladung) und die beiden Wasserstoff-Atome eine positive Teilladung. Wird nun Kochsalz in Wasser gelöst, dann entsteht ein Vorgang der sich im Fachjargon Hydratisierung nennt. In der Lösung ist jedes freie Ion vollständig von einer Hülle aus Wasser-Molekülen, einer Hydrathülle umgeben. Um das Chlorid-Ion zeigen die beiden Wasserstoff-Atome durch ihre positive Teilladung zum Chlorid-Ion. Beim Natrium-Ion zeigt der Sauerstoff mit seiner negativen Teilladung zum Natrium-Ion. Das sehe in folgendermaßen so aus: (siehe Bild)
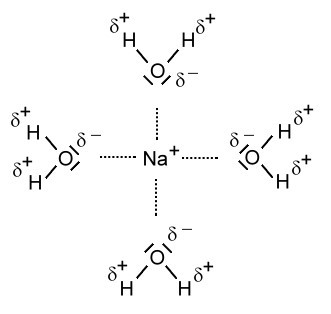
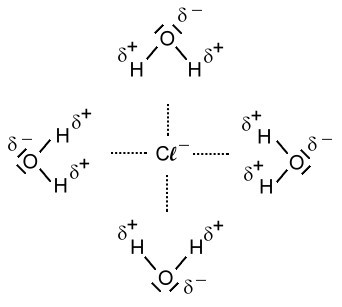
Anionen wandern weg, und Kationen wandern weg, und wenn zu viele wegwandern, ist das Salz "weg".