Fehlende Elektronenpaare von Valenzstrichformeln bestimmen?
Hallo :),
ich habe nochmal eine Frage zu den Valenstrichformeln. Die Aufgabe lautet:
Gegeben sind die folgenden Strukturformeln. Wie viele Elektronenpaare fehlen den jeweilligen Formeln, um die Struktur richtig zu beschreiben? Ladungen sind vollständig gegeben.
Bei Phosphor und Perchlorat kann ich nicht nachvollziehen, warum meine beiden Ergebnisse nicht stimmen.
Ich hoffe mir kann jemand weiter helfen ;)
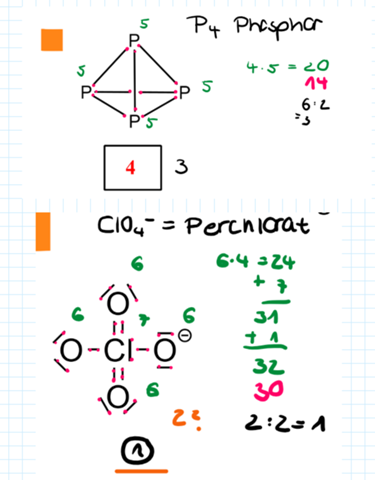
2 Antworten

Moin,
beim P4-Molekül hast du vom linken zum rechten Phosphoratom keine durchgezogene Linie EINES ELEKTRONENPAARS (= 2 Elektronen) gezählt, sondern zwei Paare (vom linken P zur „Mittellinie” und von der „Mittellinie” zum rechten P).
Das sieht aber tatsächlich so aus:
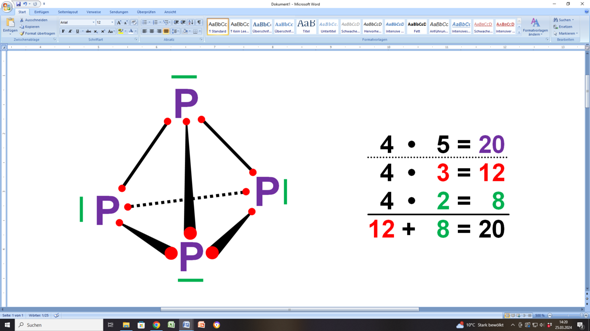
Jedes P-Atom hat fünf Außenelektronen. Das macht insgesamt 4 • 5 = 20 Elektronen.
Alle vier Ps sind durch eine durchgezogene Linie mit drei anderen Ps verbunden. Das sind insgesamt sechs bindende Elektronenpaare (6 • 2 = 12). Oder anders ausgedrückt: Jedes P steuert drei Einzelelektronen bei (rote Punkte), weshalb es 4 • 3 = 12 Elektronen gibt.
Deshalb hat jedes P noch ein freies (nicht-bindendes) Elektronenpaar (grüner Strich). Das sind dann noch einmal 4 • 2 = 8 Elektronen.
Und dann ergeben die 12 Bindungselektronen zusammen mit den 8 nicht-bindenden Elektronen 20 Elektronen...
Beim Perchlorat stimmt deine Strukturformel schon einmal nicht.
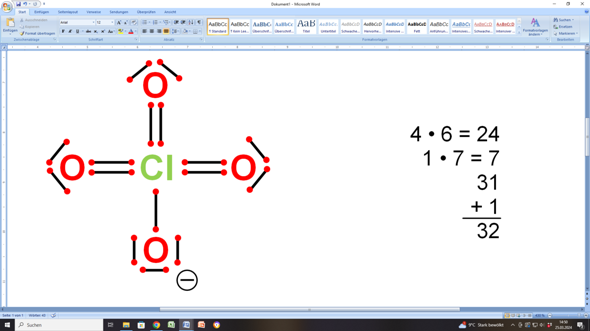
Wenn du beim Chloratom unbedingt mit Doppelbindungen arbeiten möchtest, dann sieht das so aus:
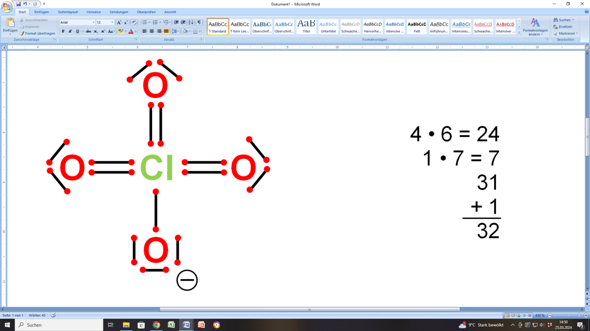
Und wenn du jetzt die einzelnen Valenzelektronen zählst, sind das 32...
Diese 32 Elektronen verteilen sich wie folgt:
- 3 Sauerstoffatome haben jeweils zwei bindende und zwei freie (nicht-bindende) Elektronenpaare (macht zusammen 3 • 8 = 24 oder 3 • 4 + 3 • 4 = 24 Elektronen)
- 1 Sauerstoffatom hat ein bindendes Elektronenpaar und drei freie (nicht-bindende) Elektronenpaare (macht zusammen noch einmal 4 • 2 = 8 oder 1 • 2 + 3 • 2 = 8 Elektronen).
- Insgesamt sind das dann 24 + 8 = 32 Elektronen, wie gefordert...
In deiner Darstellung hast du neben der falschen Strukturformel auch noch das „l” vom Chlor-Symbol als Elektronenpaar gezählt.
LG von der Waterkant


Vielen lieben Dank für die ausführliche Antwort! Ich kann es durch die Bilder und Erklärungen sehr gut nachvollziehen!

Beim P4 ist nur eine Bindung zwischen den Atomen rechts und links. Die 'Lücke' entsteht, weil die Bindung HINTER der Bindung zw. Den Atomen oben und vorn! Du zählst da aber 4 Elektronen statt 2!
Beim Chlorat hast Du das L vom Chlor (Cl) ebenfalls als Elektronenpaar gezählt. Ein Grund, weshalb ich immer empfehle das Cl in 'Schreibschrift' zu schreiben!
Ich finde die Methode auch recht umständlich und etwas unübersichtlich, weshalb ich auch etwas gebraucht habe, um die Probleme und Fehler zu finden. ALLE Atome entsprechen hier der OktettRegel, brauchen also 4 Elektronenpaare! JEDEM Phosphor fehlt das freie EP und beim Chlorat fehlen links die Doppelbindung und rechts auch ein freies EP!

Vielen Dank für die Antwort! Jetzt kann ich es gut nahvollziehen. Bei dem Perchlorat ist mir gar nicht aufgefallen, dass ich das l vom Cl dazu gezählt habe....
So wie ich es verstanden habe, sind die (unvollständigen) Formeln vorgegeben und man soll die 'Fehler' finden...