Bindungsgrad in Metallclustern bestimmen?
Hallo,
ich würde gerne wissen, wie man den Bindungsgrad in Metallclustern wie z.B. [W6Cl12]6+ bestimmt. Das Metallcluster besteht aus oktaedrisch angeordneten W-Ionen, auf dessen Oktaederkanten die Cl-Ionen sitzen. Im Holleman/Wiberg finde ich leider keine Antwort auf meine Frage und wollte mal mein Glück hier versuchen. Ich habe gelesen, dass sich die Valenzelektronenzahl im Cluster am Beispiel [W6Cl12]6+ wie folgt berechnet: 6*6(W)+8(Cl)-6(positive Ladungen)=42 Elektronen. Für die W-Cl-Bindungen werden 2*12 =24 Elektronen benötigt, sodass für den Metallkäfig nur noch 42-24=18 Elektronen übrig bleiben. Diese 18 Elektronen verteilen sich auf die 12 W-W-Bindungen. Berechnet sich der Bindungsgrad der W-W-Bindungen einfach über: 12/18 = 0,66 ? Der Bindungsgrad der W-Cl-Bindungen wäre dann ja 0,5, da sich die 24 Elektronen auf 24 W-Cl-Bindungen verteilen, oder?
Danke schon einmal im voraus :)
3 Antworten
6*6(W)+8(Cl)-6(positive Ladungen)=42 Elektronen
Das kann ich nicht nachvollziehen. Warum sollen die 12 Chlor-Atome ausgerechnet 8 Elektronen beisteuern?

Ich schlage ein anderes Denkmodell vor: Stell Dir diesen Cluster als ein W₆¹⁸⁺ vor, das durch Anlagerung von 12 Chlorid-Ionen stabilisiert wird. Wir haben also 6⋅6−18=18 Elektronen für 12 Bindungen entlang der Oktaederkanten, das entspricht formal einer 18⁄24=¾-Bindung. Etwas besser formuliert: Vermutlich enthält die MO-Landschaft solchen Vogels zumindest 9 bindende MOs, und die werden besetzt, und die werden besetzt, ergeben also insgesamt 9 volle Bindungen.
Da haben wir allerdings die Chloride vernachlässigt. Diese sind zweibindig, also fließen aus zweien ihrer vier lone pairs (vermutlich hauptsächlich p-Orbitale) Elektronen in die MOs des zentralen Clusters, und ohne Rechnung kann ich nicht sagen, ob das bindende, nichtbindende oder antibindende MOs sind. Insgesamt tragen die also auch zur Metall–Metall-Bindung bei. Ich vermute schnell, daß dabei mehr in bindende Orbitale fließt, also die Bindungsordnung erhöht wie, aber erstens ist das nur eine Vermutung, und zweitens kann ich nicht abschätzen, wieviel es ausmacht.
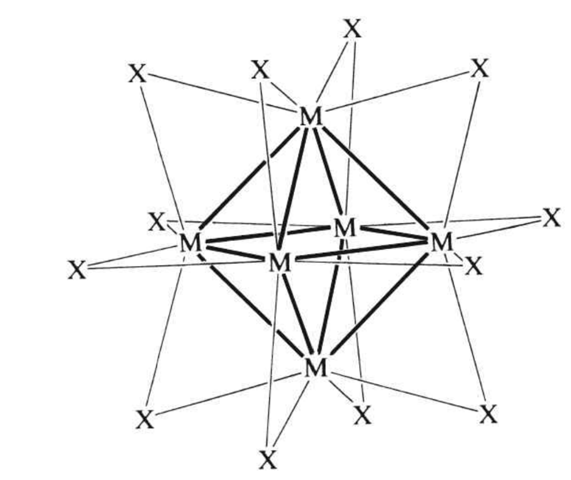
Für den Cluster W₆Cl₈⁴⁺ erhalte ich nach meinem Verfahren ein W₆¹²⁺ mit 6⋅6−12=24 Elektronen für 12 Bindungen, also dasselbe. Vermutlich machen wir also dasselbe.
Das kann schon deswegen nicht stimmen, weil du davon ausgehst, das es lokalisierte W-Cl Einfachbindungen gibt. Die gibt es in dem Cluster aber nicht. Wie du ja selber schreibst, sitzen die Chloratome auf den Kanten des Wolfram-Oktaeders, das heißt es sind mindestens mal verbrückende Mehrzentren W-Cl-W Bindungen enthalten. Von den Metall-Metall-Bindungen mal ganz zu schweigen.
Deswegen ist eine so versimpelte Betrachtung für solch komplexe (pun intended) Verbindungen ziemlich sinnlos.
Sinnvoller, aber ungleich komplizierter siehe hier. Die kommen dabei auf eine Bindungsordnung von 0,48 für die W-W-Bindungen.
Um den Bindungsgrad in Metallclustern wie [W6Cl12]6+ zu berechnen, musst du die Valenzelektronenzahl (VEZ) bestimmen und die Elektronen auf die Bindungen verteilen. Zuerst berechnest du die Gesamtzahl der Elektronen: 6 * 6 (für W) + 8 (für Cl) - 6 (für die 6+ Ladung) ergibt 42 Elektronen. Diese Elektronen verteilen sich auf die W-Cl- und W-W-Bindungen. Für die W-Cl-Bindungen werden 24 Elektronen benötigt (12 Bindungen mit jeweils 2 Elektronen), was einen Bindungsgrad von 0,5 pro W-Cl-Bindung ergibt. Die verbleibenden 18 Elektronen verteilen sich auf die 12 W-W-Bindungen, was einen Bindungsgrad von 1,5 pro W-W-Bindung ergibt. Die W-W-Bindungen haben also einen höheren Bindungsgrad als die W-Cl-Bindungen
Nein, AI hätte sicher das Mal-Zeichen (×) benutzt und nicht *
Dann ist ja gut, dass du es erklärt hast. Der Beitrags-Ersteller hätte sonst ja mit falschen Infos leben müssen
Dass die Clhorid-Ionen 8 Elektronen beisteuern war ein Tippfehler. Im Holleman/Wiberg steht, dass diese 12 Elektronen beisteuern, wodurch man auf die 42 Gesamtelektronen kommt. Die restliche Rechnung habe ich aus dem Holleman/Wiberg entnommen. Ich war aber total verwirrt, warum einfach davon ausgegangen wird, dass für die M-Cl-Bindungen 24 Elektronen benötigt werden. Hier das Zitat aus dem Holleman/Wiberg für den Cluster: [Mo6X8]4+: Die Summe der Bindungselektronen im Cluster beträgt 6x6(Mo)+8(X)-4(positive Ladungen) = 40 Elektronen. Zieht man hiervon 8 x 2 = 16 Elek-tronen für die 8 Bindungen zu den Halogenid-Ionen ab, so verbleiben für den M-Metallkäfig-wie gefordert -24 Elektronen, die sich auf die 12 MM-Bindungen des M-Oktaeders verteilen.