Chemie Gleichgewichtskonstante Aufgabe?
Aufgaben an denen Ich aktuell scheitere.
- Reagieren äquimolare Stoffmengen an Essig und Alkohol zusammen entsteht 2/3 Stoffmengen Ester und Wasser. Wie groß ist die Gleichgewichtskonstante K?
-Ergebnis von mir aktuell K=0.44
- Wie viele Mol Essig müssen auf 1 mol Alkohol einwirken damit ein Umsatz an Ester von 90% erzielt wird.
-Ergebnis von mir aktuell 1,82
Ist das so richtig und falls ja warum? Und falls nicht warum? Vielen Dank im voraus.
2 Antworten
CH₃COOH + C₂H₅OH ⟶ CH₃COOC₂H₅ + H₂O
Wenn Du lt. Angabe je ein Mol der Edukte zur Reaktion bringst, dann bekommst Du je ⅔ mol der Produkte; folglich bleiben je ⅓ mol der Edukte im Gleichgewicht übrig. Der Ausdruck für die Gleichgewichtskonstante lautet
K = c(Ester)⋅c(Wasser) / (c(Säure)⋅c(Alkohol) = ⅔⋅⅔ / (⅓⋅⅓) = 4
Als nächstes ist gefragt, wieviel Säure Du brauchst, um 1 mol Alkohol zu 90% zu verestern. Du kübelst also x mol Säure und 1 mol Alkohol in den Topf, und Du erwartest, daß Du 0.9 mol Ester (und natürlich ebensoviel Wasser) im Gleichgewicht findest. Dann muß die Alkoholmenge im Gleichgewicht natürlich 1−0.9=0.1 mol betragen, und die Säuremenge folglich x−0.9 mol. Das setzen wir ins Gleichgewicht ein und lösen nach x auf:
K = Ester⋅Wasser / (Säure⋅Alkohol) = 0.9² / (x−0.9) / 0.1 = 8.1 / (x−0.9)
⟹ x = 8.1/K + 0.9 = 2.93 mol
Man braucht also einen fast dreifachen Überschuß es Alkohols.
Und hier siehst Du das ganze noch allgemeiner: Auf der x-Achse ist aufgetragen, wieviel mol Ester Du aus einem Mol Alkohol gewinnen möchstst, und die y-Achse sagt Dir, wieviel Mol Säure Du dazu brauchst (Du kannst „Säure“ und „Alkohol“ auch vertauschen, die Graphik bleibt dieselbe)
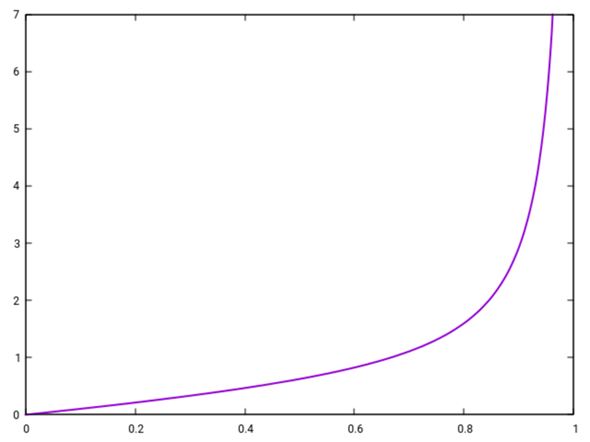
Du siehst, daß die beiden zuvor berechneten Ergebnisse (x=⅔, y=1 und x=0.9, y=2.93) auf dieser Kurve liegen, also Spezialfälle der allgemeinen Lösung sind. Allgemein kannst Du aus x=gewünschte Ausbeute dasdazu notwendige y berechnen als:
y = x²/(1−x)/K + x
-Ergebnis von mir aktuell K=0.44
Kann ja nicht sein, wenn am Gleichgewicht mehr Produkt (2/3) als Edukt (1/3) vorliegt. K ist dann allemal größer als 1.
K = c(Ester)*c(Wasser)/(c(Säure)*c(Alkohol)
Nun muss man unterscheiden zwischen den Mengen Säure und Alkohol, die zur Reaktion eingesetzt wurden, sagen wir jeweils 1 mol und den Mengen, die am Gleichgewichtspunkt vorliegen, wo ja bereits ein Teil der eingesetzten Mengen umgesetzt wurden. Gehen wir von 1 mol Edukte aus, dann sind die Gleichgewichtsmengen:
K = (2/3 * 2/3) /[(1-2/3)*(1-2/3)] = 4
Mit dieser Korrektur kannst Du jetzt noch einmal die 2. Frage angehen.