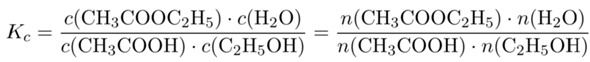Wie berechne ich dafür die Gleichgewichtskonstante Kc?
Lässt man Essigsäure mit Ethanol reagieren, bildet sich Ethylethanoat und Wasser. Berechnen Sie den Wert für Kc, wenn man 2 mol Ethanol und 5 mol Essigsäure unter Zusatz von etwas Schwefelsäure als Katalysator in einem 2l Kolben erhitzt. Im Gleichgewicht findet man 1.6 mol Ester.
2 Antworten
Ja aber ich verstehe nicht, warum es gleich so viel Ester, wie Wasser gibt. Ich hatte die molare Masse von Ester und Wasser berechnet und wir wissen schon die Stoffmenge von Ester. Daher habe ich das Verhältnis gebildet und habe so die Stoffmenge von Wasser berechnet.
CH₃COOH + C₂H₅OH ⟶ H₂O + CH₃COOC₂H₅
Aus 2 mol Ethanol und 5 mol Essigsäure bilden sich 1.6 mol Ester im Gleichgewicht.
- Die Bildung von 1.6 mol Ester verbraucht 1.6 mol Ethanol, also bleiben im Gleichgewicht von den anfangs vorhandenen 2 mol noch 0.4 mol Ethanol übrig.
- Ebenso bei der Essigsäure; im Gleichgewicht sind noch 3.4 mol vorhanden.
- Zugleich mit dem Ester bilden sich auch 1.6 mol Wasser
Nun schreiben wir den Gleichgewichtsausdruck zur Reaktion an. Da die Gleichgewichtskonstante dimensionslos ist (gleich viele Konzentrationen in Zähler und Nenner, weil sich durch die Reaktion nichts an der Teilchenanzahl ändert), darf man die Konzentrationen durch Stoffmengen ersetzen, was in diesem Fall ganz bequem ist:
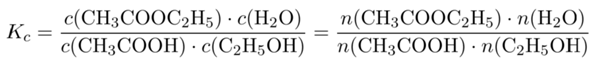
Jetzt brauchst Du nur noch die Zahlen einzusetzen; die Lösung ist K=1.6²/0.4/3.4=1.9