Wieso hat Eisen 8 Außenelektronen?
4 Antworten
Hi,
dazu schauen wir uns einmal die Elektronenkonfiguration von Eisen an.
Wir besetzen Ddie Orbitale in folgender Reihenfolge:
1s - 2s - 2p - 3s - 3p - 4s - 3d.
Das 1s-Orbital fasst zwei Elektronen, die drei p-Orbitale insgesamt sechs und die fünf d-Orbitale insgesamt zehn Elektronen. Auf diese Orbitale verteilen wir nun 26 Elektronen:
K-Schale: 1s² - zwei Elektronen weg, Schale voll besetzt
L-Schale: 2s² 2p^6 - acht Elektronen weg (insgesamt 10), Schale voll besetzt
M-Schale: 3s² 3p^6 - acht Elektronen weg (insgesamt 18), Schale voll besetzt
Nun kommt die entscheidende Schale: die N-Schale, in der auch die 3d-Orbitale besetzt werden:
4s² 3d^6 sind die restlichen acht zu besetzenden Elektronen.
Eisen hat also so betrachtet zwar sechs, nach dem Bohrschen Modell aber nur zwei Außenelektronen. Aber: Eisen kann nicht nur die Oxidationsstufe +II, sondern auch die Oxidationsstufe +III annehmen. Da müsste man jetzt aber ausholen und das würde hier zu weit führen.
LG
Eisen kann auch +VI annehmen (das Ion heißt dann Ferrat), das passt doch zu den sechs Elektronen.
Guten Morgen, danke erstmal für dir Auszeichnung als hilfreichste Antwort! Nun zu deinen Fragen:
Hä, aber was ist nun mit den 4s Orbitalen?
Die werden doch besetzt, vor den 3d-Orbitalen.
Und warum hat Fe laut dem Borschen Atommodell nur 2 Außenlektronen, was ist hierfür die Erklärung,
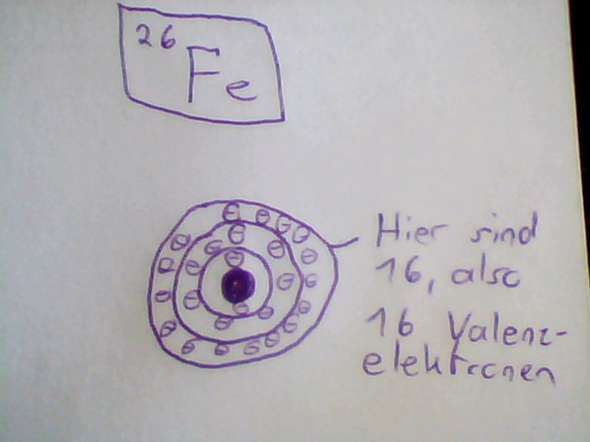
Bei den bohrschen Atommodell schaust du dir die Schalen an, keine Orbitale. Das bohrsche Modell macht die Annahme, dass sich die Elektronen auf geordneten Bahnen in gleichbleibender Geschwindigkeit bewegen. Heisenberg hat aber gezeigt, dass du von einem Elektron nicht gleichzeitig Ort und Geschwindigkeit angeben kannst, weshalb sich die Elektronen in „Gegenden“, den Orbitalen aufhalten. Beim bohrschen Modell besetzt du also nach und nach die Schalen, wie du es gelernt hast. Und weil die Elektronen der Nebengruppen die vorletzte Schale besetzen, bleiben auf der Valenzschale nur zwei Elektronen über. Das ist aber, wie man am Atommodell sieht, nur die halbe Wahrheit.
und warum gibt es dann Eisen(III), denn es gibt ja nur die Möglichkeit 2 und 6 Valenzelektronene?
Es gibt nicht nur diese Möglichkeiten. Für Eisen (III) muss man jetzt in die Ligandenfeldtheorie einsteigen. Eisen ist ein Zentralatom, das die Liganden in oktaedrischer Anordnung um sich anordnet. Bei Eisen(III) hast du fünf d-Elektronen. Diese kannst du auf dem oktaedrischen Ligandenfeld schön auf alle fünf Orbitale verteilen. Du hast ein höchst paramagnetisches Zentralatom, das eine hohe Zahl an ungepaarten Elektronen aufweist, daher sehr instabil ist und gern reagiert. Das wär meine Erklärung, ich kann mich aber auch irren, da Fe(III) für mich auch oft ein Mysterium ist ;)
Du bekamst dir die Auszeichnung weil du sie sehr verdient hast :), denn deine Antwort war großartig.
Die werden doch besetzt, vor den 3d-Orbitalen.
Naja, aber die Besetzung der Schalen ist ja 4s² 3d^6 und 2+6 zusammengezählt ergeben doch acht, weshablb Eisen doch 8 Außenelektronen haben solte, oder?
Erste Schale: 2 Elektronen, 1s², voll und abgeschlossen, bleiben 24
Zweite Schale: 8 Elektronen, 2s² 2p⁶, voll und abgeschlossen, bleiben 16
Dritte Schale: 8 Elektronen, 3s² 3p⁶, vorübergehend voll, bleiben 8
Vierte Schale: 2 Elektronen 4s², jetzt ist die dritte wieder offen, bleiben 6
Dritte Schale: 6 Elektronen, 3d⁶, immer noch Platz aber alle Elektronen verbraucht
Die „acht Außenelektronen“ sind die zwei in der vierten Schale plus die sechs zuletzt zugefügten in der dritten Schale. Denn diese acht Elektronen machen Chemie, die anderen schauen nur zu.
Fe befindet sich in der 8. Nebengruppe und hat dementsprechend 8 e- außen. Soweit wir es gelernt haben, die Gruppe entspricht der Anzahl der Außenelektronen. Schau dir mal das Periodensystem an.
Hat es nicht. Das Bohrsche Atommodell funktioniert nur anschaulich mit s und p-Orbitalen. Bei Elementen der Übergangsgruppen funktioniert diese Darstellung nicht.
Hä, aber was ist nun mit den 4s Orbitalen?
Und warum hat Fe laut dem Borschen Atommodell nur 2 Außenlektronen, was ist hierfür die Erklärung, und warum gibt es dann Eisen(III), denn es gibt ja nur die Möglichkeit 2 und 6 Valenzelektronene?