Wie viel Mol und wie viel Moleküle sind in 75g von bestimmten Stoffen enthalten?
Moin Leute,
ich weiß was 1 Mol ist. 1Mol= 6,022*10^23 Teilchen
Diese 6,022*10^23 passen in1 g Wassersoff.
Also ist 1 Mol H= 1g
Ich verstehe trotzdem diese Aufgabenstellung nicht, kann mir wer helfen? Siehe Bildmaterial Danke voraus
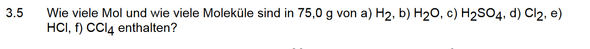
6 Antworten

Nehmen wir mal H₂SO₄ als Beispiel. Das hat die molare Masse 98 g/mol. Daher sind 98 g H₂SO₄ genau 1 mol bzw. 6·10²³ Teilchen.
75 g sind dann 75/98=0.765 mol bzw. 4.61·10²³ Moleküle.

Das ist die molare Masse, die kriegst Du als Summe der Atommassen (und die stehen im Periodensystem oder sonstwo): 2·1+32+4·16=98



Multipliziere die Stoffmenge (0.765 mol) mit der Avogadrokonstante (6.022⋅10²³ mol⁻¹).

Nein, eine Zahl ist abstakt und passt in nichts reales.
Und real bildet Wasserstoff Moleküle mit 2 Atomen, die Formel lautet H₂.
Also wären ein Mol (molekularer) Wasserstoff ca. 2 g.
Und 75 g Wasserstoff wären demnach 75/2 = 37,5 Mol.
CCl₄ besteht auch aus Molekülen, aus einem C- und 4 Cl-Atomen.
Ein C-Atom hat die Masse 12 u, jedes Cl-Atom eine solche von ca. 35¼ u, zusammen also 12 + 4 * 35¼, also 153 u.
Ein Mol CCl₄ sind also ca. 153 g.
75 g CCl₄ sind also ca. 75/153 = 0,49 Mol.
Die Atommassen muss du natürlich im PSE nachschlagen, wie man weiterrechnet, muss du verstehen.


Darf ich damit unseren Streit von neulich, als du über mich schriebst
manche können ihr Themengebiet, sind aber im erklären so zurückgeblieben wie ein Kleinkind.
als erledigt betrachten?
Ich zumindest bin selten nachtragend.

Ja können wir als vergessen betrachten, war nur wütend gewesen.

Also dazu brachst du folgende gleichung: n=m/M, n ist die stoffmenge (in mol), m ist die masse der stoffportion (in g) und M ist die Molare masse (in g/mol). Naja wenn du stoffmenge n ausgerechnet hast, multiplizierst du sie einfach mit der avogadro konstante! Das mol ist wie eine eierpackung, in einer eierpackung hast du 12 eier, wenn ich dich frage, wie viele eier sind in 5 eierpackungen, dann ist es einfach 5*12 also 60! In einem mol sind immer ca 6,022 * 10^ 23 Teilchen, stell dir das analog zu den eierpackungen vor! Nun ist es aber so, das eine eierpackung ja auch straußeneier enthalten kann, es ändert sich also nichts dadran, dass eine eierpackung 12 eier hat, aber mit 12 straußeneiern ist eine packung viel schwerer, die molare masse gibt an, wie schwer so eine eierpackung einer bestimmten eisorte ist! Wenn ich dich frage, wie viele eier sind in 5 kg eierkiste drin, dann rechnest du ja 5kg / das gewicht einer eierpackung und bekommst die anzahl der eierpackungen, welche du mit 12 multiplizierst, weil in einer packung sind ja 12 eier :)
Um rauszufinden wie viele moleküle H2 in 75 gramm sind rechnest du 75g/2g/mol (2 g/mol weil es ja 2 atome H in einem molekül sind) und das ergebnis mal 6,022 * 10^23. Denk dran, wenn du zb H2O hast ist die molare masse die summe aller drin vorkommenden atome, also molare masse von 2 H atomen + molare masse von einem O atom = molare masse H2O. Lg

Also ist 1 Mol H= 1g
Ungefähr. Genau genommen ist es etwas mehr und zwar, weil
- es in natürlichem Wasserstoff auch geringe Mengen Deuterium, also Wasserstoff mit einem Neutron gibt und
- die Definition der atomaren Masseneinheit auf ¹²C (ein Kern mit 6 Protonen und 6 Neutronen) ausgelegt ist, von dem 1 Mol exakt 12g Masse hat. Kohlenstoff wird aber in einer thermonuklearen Reaktion in Sternen erbrütet, wobei Bindungsenergie ΔE frei wird, die wiederum die Effektivmasse ΔE/c² besitzt. 12 ganz normale ¹H-Atom haben also auch schon als solches etwas mehr Masse als ein ¹²C-Atom.
Aber im Prinzip hast Du Recht. Natürlich werden bei hinreichender Dichte und nicht allzu großer Temperatur.
Die Aufgabe besteht darin, bei einem Molekül, nehmen wir H₂O, erst einmal festzustellen, welche und wie viele Atome darin sind. In diesem Fall sind dies 2H mit je etwa einem amu (atomic mass unit) oder u (einfach Unit) und O mit je 16amu. Zusammen ergibt dies ca. 18u, und da dies die Masse des einzelnen Moleküls und zugleich vom Zahlenwert her die Molmasse M. Teilst Du die gewünschte Masse durch die Molmasse, kommt die Stoffmenge heraus, bei Wasser
n(1g H₂O) = m/M(H₂O) = m/(18g/mol) ≈ 55mol.
So ist mit den anderen Molekülen auch zu rechnen.

Also die Formel, die du benötigst ist n=m/M
Dabei ist n die Stoffmenge in mol, m die Masse in g und M die molare Masse in g/mol. Die Molare Masse ist bekannt. Die kannst du dir z.B. im PSE anschauen. Und m ist bei dir 75g. Jetzt kannst du die Stoffmenge ausrechnen und das Ergebnis mit 6,022*10^23 Teilchen multiplizieren, damit du weißt wie viele Teilchen du hast.
Danke, wie bist du aber auf 98 g/mol gekommen?