Was ist das Bohrsche Atommodell?
Eine einfache Erklärung am besten.
2 Antworten
Hi,
ich erkläre dir am Beispiel Natrium, wie man nach dem Bohrschen Atommodell ein Natriumatom zeichnet. Ich hoffe du weißt, wie man mit dem Periodensystem arbeitet.
Zunächst übernimmst du die Informationen, die du zu Natrium im Periodensystem findest, und interpretierst sie:

Wenn das geschehen ist, dann kümmerst du dich erstmal um das "Gerüst" des Atoms. Das heißt: Du zeichnest den Kern (der Kreis in der Mitte), trägst die Anzahl der Protonen ein und machst ein + oben rechts an die Zahl. Das sagt aus, dass der Kern aus 11 Protonen besteht (und ein Proton hat ja eine Ladung von +1). Dann zeichnest du erstmal alle Schalen auf:
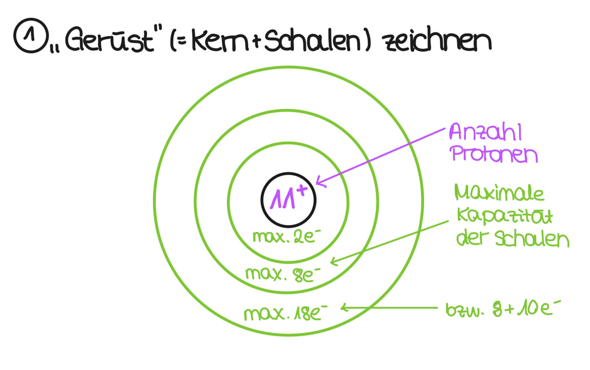
Du siehst, dass ich in die Schalen was von maximaler Elektronenzahl aufgeschrieben habe. Um das zu verstehen, schaust du am besten mal ins Periodensystem. Du siehst, dass in der ersten Periode nur H (also Wasserstoff) und He (also Helium) stehen. Das heißt: Nach zwei Elektronen ist diese Schale voll. Die nächste Schale kann schon acht Elektronen aufnehmen, da in der Reihe Lithium, Beryllium etc stehen, bis hin zum Neon. Auch bei der dritten Schale ist dies so. Warum aber habe ich da "18 bzw. 8 + 10" hingeschrieben? Das liegt daran, dass in der nächsten Periode die Nebengruppenelemente kommen und die die Schale davor auffüllen. Das heißt, die Nebengruppenelemente in Periode 4 füllen die dritte Schale auf. Für unseren Zweck reicht es aber, dass es erstmal die 8 Elektronen aus der dritten Periode maximal aufnehmen kann.
Nun hast du 11 Elektronen. Diese füllst du von innen nach außen auf:
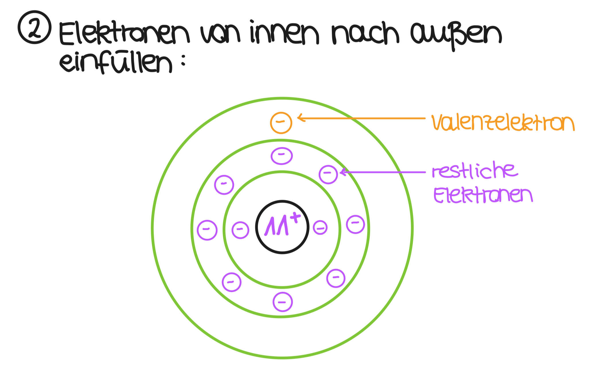
Wenn du das so machst, hast du deine 11 Elektronen passend eingefüllt und, wie es die Hauptgruppe schon vorgibt, ein Elektron auf der äußersten Schale. Damit ist die Zeichnung des Natriumatoms schon fertig.
Bei Nebengruppenelementen musst du, wie schon angedeutet, aufpassen. Da wird die vorletzte Schale bzw. bei Lanthaniden und Actiniden die drittletzte Schale aufgefüllt.
LG

Danke für das Kompliment und sehr gern geschehen! Freut mich, dass ich dir helfen konnte :)
Quasi - das Referendariat habe ich noch vor mir. Habe letztes Jahr mein Lehramtsstudium unter anderem für Chemie beendet. :)
Eigentlich ist das das SchalenModell...
Aber das ist das, was meist im Unterricht beigebracht wird!
Ah, ich verstehe deinen Punkt. Letztlich ergibt sich das Schalenmodell aus den Annahmen, die Bohr traf: Die Elektronen kreisen auf festen Bahnen und es gibt bestimmte Energieniveaus, auf denen die Elektronen sich befinden und zwischen denen Quantensprünge unter Aussendung von Photonen vollzogen werden können. Dass das wissenschaftlich irgendwann nicht mehr ganz genau ist und man sich anderer Modelle bedienen muss, ist für Unsereins auch klar, aber das braucht einen Schüler in Klasse 8 nicht zu interessieren.
Woher weißt Du, dass er in der 8. Klasse ist? Aber das ist nicht 'mein Punkt'!
Im Bohrmodell gibt es definierte EnergieStufen, aber keine Vorgabe für die Anzahl der möglichen Elektronen! Die Stufen gab es schon vorher, aber Bohr konnte sie in einem geschlossenen und berechenbaren Modell herleiten, während die BalmerFormel usw. nur gut 'geraten' wurde!
Als FachFrau solltest Du die unterschiedlichen Modelle auch unterscheiden können und sie nicht vermischen! Und wenn jemand nach dem Modell von Bohr fragt dieses auch erklären können! Man kann aber natl. zusätzlich ein paar 'kritische Anmerkungen' machen.
Im BohrModell kreisen die negativen Elektronen auf festen Bahnen um den positiven Kern, wie Planeten um eine Sonne, oder Monde um einen Stern.
Dabei ist die elektrostatische Anziehung die Zentripetalkraft, aus der man Radien und auch Geschwindigkeiten berechnen kann.
Mit weiteren Annahmen und Formeln ergeben sich ganz bestimmte Energiestufen und damit Radien (die es weder bei Planeten, noch in Atomen gibt). Diese Energiestufen stimmen allerdings beim Wasserstoff hervorragend mit spektroskopischen Daten, den Quantensprüngen, überein, weshalb es auch nach 100 Jahren noch sehr beliebt ist, obwohl es mehrere Fehler hat!
Es gibt keine Bahnen, keine Geschwindigkeiten, eine festen Radien, ...Atome sind keine flachen Scheiben und die Energiestufen müssen ohne echte Erklärung 'angeommen' werden.
Warum müssen wir sowas lernen wenn es falsch ist? Hä 😂
Es ist physikalisch und wissenschaftshistorisch interessant! Teilweise (Bei H-Spektren) ist es ja auch anwendbar. In der Mittelstufe macht man das aber schon lange nicht mehr (in D?) und selbst im Physik LK sollte man es auch nicht machen.
Trotzdem gibt es SEHR viele mit der Vorstellung von Bahnen und Geschwindigkeiten! Vor allem Amis(?) und in englisch-sprachigen Staaten scheint es iwie üblich zu sein!
Nennen wir es eher "ungenau". Wie bei allen Modellen, gelten sie nur in bestimmten Grenzen und werden dazu genutzt, einen Sachverhalt zu erklären. Für dein Wissensniveau reicht das Bohrsche Atommodell bzw. das sich daraus ergebende Schalenmodell erstmal völlig aus, um entsprechende Beobachtungen aus der Chemie und Physik zu erklären.
In der Oberstufe lernst du, warum das Modell ungenau ist und wie man das Atom noch genauer beschreiben kann. Das braucht dich aber jetzt noch nicht interessieren.
In welchem Bundesland unterrichtest du? In Berlin wird das noch in Klasse 8 gelehrt und erst in der Oberstufe über die Heisenbergsche Unschärferelation das Orbitalmodell eingeführt. Wurde das bei euch aus dem Curriculum gestrichen?
Warum müssen wir sowas lernen wenn es falsch ist? Hä
Diese Modell ist einfach und hilfreich. Natürlich kannst du auch das viel genauere und "richtigere" quantenmechanische Modell nachlesen, aber da wirst du vermutlich dann sagen, dass du es soo genau auch wieder nicht wissen wolltest.
Na, in der Mittelstufe gibt es das TeilchenModell, KernHülleModell (Rutherford), dann SchalenModell, ElektronenWolkenModell (EPA)...
Orbitale sind in der Oberstufe längst gestrichen, Heisenberg gibts in Physik, aber kein BohrModell! DAS hast Du ja auch nicht erklärt!
Ach du Heilige 😳 mit so einer guten Antwort hätte ich niemals gerechnet... vielen dank!!