Warum hat Wasserstoff nicht eine höhere Elektronegativität als Fluor?
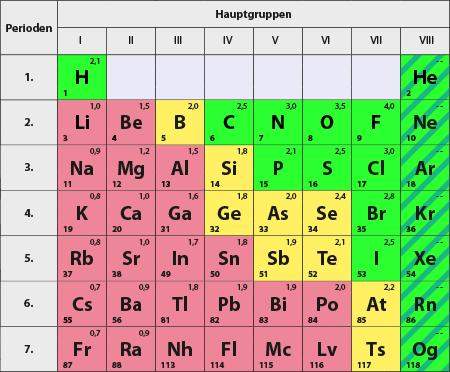
Während Fluor die größte Elektronegativität mit 4,0 hat, hat Wasserstoff nur 2,2. Und das obwohl beide nur mehr ein Atom brauchen um im Edelgaszustand zu sein. Außerdem ist das Elektron des Wasserstoffatoms in einer kovolenten Bindung näher am Atomkern als bei einem Fluoratom. Erste Vermutung war jetzt, dass Wasserstoff einfach zu wenig positive Ladung durch nur ein einziges Proton besitzt. Aber weshalb hat dann Chlor weniger Elektronegativität als Fluor, obwohl Chlor ja viel mehr Protonen hat?
2 Antworten
Das ist ein Wechselspiel zwischen Kernladung und Abstand der Elektronen. Fluor ist ein sehr kleines Atom mit hoher Kernladung. Wasserstoff ist zwar kleiner, hat aber auch viel weniger Kernladung. Bei Chlor ist es anders rum. Das hat eine höhere Kernladung als Fluor, aber seine äußeren Elektronen sind viel weiter weg vom Kern.
Die Kernladung wird durch eine geschlossene Elektronenschale nach außen abgeschirmt oder neutralisiert. Aber nur nach außen, nicht innerhalb der Schale.
So wirkt auf das Elektron des H-Atoms eine positive Ladung, auf die Elektronen des He-Atoms wirken 2. Deshalb hat He eine höhere Ionisierungsenergie als H.
Beim Li wirkt auf das Außenelektron nur eine positive Ladung, denn 2 Ladungen werden durch die erste Schale abgeschirmt. Li hat deshalb eine deutlich geringere IE als He, und auch als H, weil das Außenelekton weiter vom Kern weg ist. Die wirksame erhöht sich dann auf 7 (9-2) bzw. 8 (10-2) bei F bzw. Ne. OK, Neon reagiert nicht, aber F hat die höchste EN, weil die Außenelektronen von 7 Ladungen angezogen werden.
Von Na bis Cl bzw. Ar wiederholt sich das Spiel, auch die Außenelektronen des Cl werden von 7 Ladungen angezogen, aber sie sind noch weiter außen, deswegen ist die EN geringer als die von F.
Also liegt der Grund darin, dass Elektronenorbitale/Schalen weit voneinander entfernt sind und deshalb die Bindungselektronen z.B. bei Chlor schon zu weit entfernt sind und deshalb weniger angezogen werden und Wasserstoff zieht deshalb weniger weils zu wenige Protonen hat? Also quasi die goldene Mitte?😅 oder?