Titrationskurve mehrprotonige Säuren (Kohlensäure)?
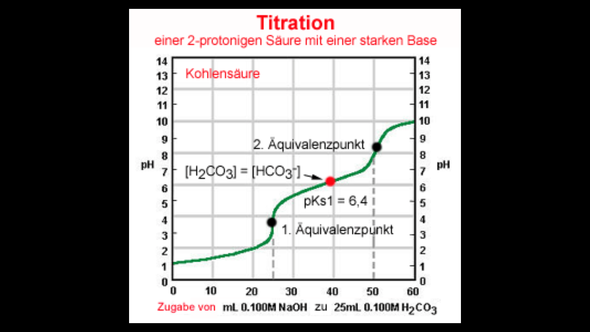
Hey ihr, brauche dringend eine Erklärung! Wie ihr den Bild entnehmen könnt heißt es am roten Punkt (Halbäquivalenzpunkt): n(H2CO3) = n(HCO3^-).Wäre aber nicht eigentlich n(HCO3^-) = n(CO3^2-) richtig? Wenn nicht, warum?
Dankesehr im Voraus!
2 Antworten
beides nicht: an diesem Wendepunkt liegt die Hauptmenge als HCO3- vor (Pufferpunkt, -Bereich) und nH₂CO₃=nCO₃²⁻, er liegt genau zwischen den beiden Umschlagpunkten.
sorry, ich glaub, ich hab mich verheddert! Alles zurück! (dabei war das früher mal meine Spezialität! Alzheimer lässt grüßen!
bitte sag mir, dass ich nicht völlig falsch liege, sonst verzweifle ich komplett!
Du hast recht.
Woher stammt das Diagramm?
Vertiefungsfrage: Warum ist die im Diagramm angegebene Titration ungeeignet zur Bestimmung von Kohlensäure? Wie könnte man es besser machen?
gut, ich war gerade schon richtig am Verzweifeln :D
die Quelle: http://www.biokurs.de/chemkurs/skripten/cs11-26.htm
Leider finde ich ansonsten keine Titrationskurve einer zweiprotonigen Säure die passend beschriftet ist!
Ich weiß nicht, was schlägst du vor?
Besseres Beispiel: http://www.chemieunterricht.de/dc2/os/os-aciditaet.htm
Dein Diagramm mit Kohlensäure beginnt bei pH=1. Mal abgesehen davon, dass 0,1 m Kohlensäure (schwache Säure!) eher bei pH=3.x liegen dürfte: Was macht wohl die im Becherglas befindliche Kohlensäure bei pH=1?
Dein Diagramm aus dem Bioskript ist ominös: Dass bei pH=6.35 gleiche Mengen Kohlensäure und Hydrogencarbonat vorliegen, ist nämlich richtig. Falsch ist aber der erste Äquivalenzpunkt im Sauren, und natürlich der gezeichnete Kurvenverlauf.
Das kann ich mir überhaupt nicht erklären.
Nehmen wir an, dass die erste Dissoziationsstufe fast vollständig verläuft. Dann gilt am ÄP1: n(HCO3^-) = n(OH-) bzw n(H3O^+) = n(OH^-)
und am ÄP2: n(CO3^2-) = n(OH^-) bzw. n(H3O^+) = n(OH^-)
und folglich am HÄP: n(HCO3^-) = n(CO3^2-).
Oder wo liegt der Fehler in meinem Vorgehen?