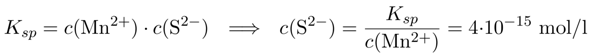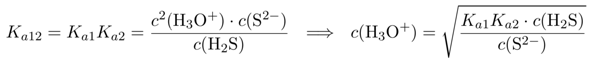Säure-Base-Chemie Löslichkeit und pH-Wert einstellen?

Nochmal eine ähnliche Frage wie die zuvor, nur hier bin ich leider schon beim Ansatz ziemlich raus. Kl besteht ja aus c(Mn2+) mal c (HS-) im Quadrat. Wie komme ich auf die Konzentration an HS-, einfach umstellen, wie sonst auch? Welchen Zusammenhang spielen dabei die pKS-Werte der verschiedenen Protolysestufen? Und wie bekomme ich aus den zwei Werten meinen H3O+-Wert?
Wäre sehr dankbar für jede Hilfe.
1 Antwort
Du sättigst eine 0.25 mol/l Lösung von Mn²⁺ mit H₂S (0.1 mol/l) sättigen und willst den pH-Wert so sauer eingestellt haben, daß kein MnS ausfällt.
Dazu müssen wir uns als erstes fragen, wie hoch die Konzentration c(S²⁻) überhaupt sein darf, damit das MnS in Lösung bleibt. Dazu schreiben wir das Löslichkeitsgleichgewicht an und lösen nach c(S²⁻) auf:

Die Sulfidkonzentration darf also 4⋅10⁻¹⁵ mol/l nicht übersteigen, sonst fällt MnS aus. Andererseits wissen wir, daß die Lösung 0.1 mol/l H₂S enthält, und das müssen wir in Sulfid umrechnen. Dazu schreiben wir die Gesamtdissoziation des H₂S auf, das ist die Summe der beiden Einzeldissoziationen, daher ist die Gleichgewichtskonstante Kₐ₁₂ einfach das Produkt Kₐ₁⋅Kₐ₂
H₂S + 2 H₂O ⟶ S²⁻ + 2 H₂O⁺
Das setzen wir jetzt ein und formen um:

damit bekommen wir c(H₃O⁺)=5⋅10⁻⁵ mol/l bzw. pH=4.3 als die nötige Acidität, daß das H₂S so wenig S²⁻ bildet, daß kein MnS ausfallen kann.
Man sieht also, daß es nicht sehr sauer sein muß, um das MnS am Ausfallen zu hindern; selbst eine essigsaure Lösung reicht dazu. Du kannst dieselbe Rechnung für einige andere Sulfide machen und wirst feststellen, daß die anderen Sulfide auch in stärkerer Säure noch löslich sind, z.B. FeS bis pH 3.2, CoS bis pH 1.7 und PbS fällt selbst aus konzentrierter HCl zuverlässig aus. Man kann also diese Metalle über die Löslichkeit ihrer Sulfide in Säure voneinander trennen.