Potential einer Konzentrationskette?
Berechnen Sie das Potenzial der Konzentrationskette.
Fe³⁺ + e⁻ --> Fe²⁺
EO = 0,771V
Halbzelle 1: Fe³⁺ mit c(Fe³+) = 2 mol/L
Halbzelle 2: Fe²⁺ mit c(Fe²+) = 0,001 mol/L
Mit der Formel ▲E = 0,059 * log([OX]/[RED]) auf
▲E = 0,059 * log(0,001/2) = -0,195 V
In der Lösung steht 0,97 V
Wo liegt mein Fehler, bzw. welche Formel hätte ich benutzen müssen?
Hier die Frage im Original:
Berechnen Sie das Potential der folgenden Konzentrationskette. Bitte nur den Zahlenwert ohne Einheit angeben (Ergebnis in Volt).
Fe3+ + e- → Fe2+ mit E0 = 0,771 V
Halbzelle 1: Fe3+ mit c(Fe3+) = 2,0 mol/L
Halbzelle 2: Fe2+ mit c(Fe2+) = 0,0010 mol/L
Kannst Du bitte die ganze Angabe im originalen Wortlaut hinschreiben? Es ist wohl keine Konzentrationskette gemeint, aber ich kann nicht erraten, was wirklich auszurechnen ist.
Müsstest du jetzt sehen können
2 Antworten
Ich verstehe die Aufgabe nicht. Offenbar hat es irgendetwas mit der Reaktion
Fe³⁺ + e⁻ ⟶ Fe²⁺
zu tun. Deren Standardreduktionspotential ist ε⁰(Fe³⁺/Fe²⁺)=0.771 V, das paßt also zur Angabe.
Aber wenn es wirklich um eine Konzentrationskette geht, dann ist das ε⁰ egal, weil es sich aus der Nernst-Gleichung heraushebt (in jeder Halbzellen findet ja genau die Umkehrreaktionen der anderen statt). Außerdem braucht eine solche Konzentrationskette beide Ionen, Fe²⁺ und Fe³⁺, in beiden Halbzellen, und dafür sind nicht genug Konzentrationsangaben gegeben.
Alternativ könnte die Frage gemeint sein als: Welches Elektrodenpotential hat eine einzelne Halbzelle mit c(Fe³⁺)=2 mol/l und c(Fe²⁺)=0.001 mol/l? Dafür braucht man die Nernst-Gleichung für eine einzelne Halbzelle:
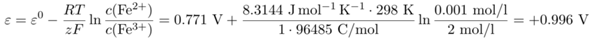
Wenn man den Vorfaktor vor dem Konzentrationsterm mit den bekanntermaßen ungenauen 59 mV (und dekadischem Logarithmus) anschreibt, dann kommen 0.966 V heraus. Das paßt zwar zu Deiner Lösung, aber darin stecken zumindest eineinhalb Fehler: Erstens hat das ganz bestimmt nichts mit einer Konzentrationskette zu tun, und zweitens verlangt der genaue Zahlenwert absichtlich ungenaue Rechnerei (und in der Praxis kann man sich schon selbst den A… küssen, wenn man bei so einer Messung auch nur die Zehntelvolt richtig hinbekommt).
Oder stehe ich voll am Schlauch?
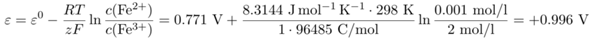
Danke für die ausführliche Erklärung. Meiner Meinung nach reichen die 2 Angaben über die Konzentration auch nicht für die Berechnung.
0,77V + 0,059V×lg(2/0,001) = 0.9648V
Man könnte auch
0.77V - 0.059V×lg(0.001/2) = 0.9648V
schreiben, aber plus ist immer schöner als minus.
Der Begriff der Konzentrationskette passt zwar nicht, da stimme ich definitiv zu, aber ich glaube, dass eben diese Rechnung erwartet wird. Dafür spricht auch, dass die Ox. Zelle Eisen(II) enthält und nicht auch Eisen(III). Ich?dachte zwar erst, dass das ein Fehler des Fragestellers gewesen sei, aber anscheinend liegt der Fehler in der Aufgabenstellung.
Hältst Du das wirklich für eine Antwort auf die gestellte Frage nach einer Konzentrationskette (also zwei Zellen gefüllt mit denselben Spezies in unterschiedlichen Konzentrationen)? Entweder stehe ich heute neben mir, oder das paßt überhaupt nicht.