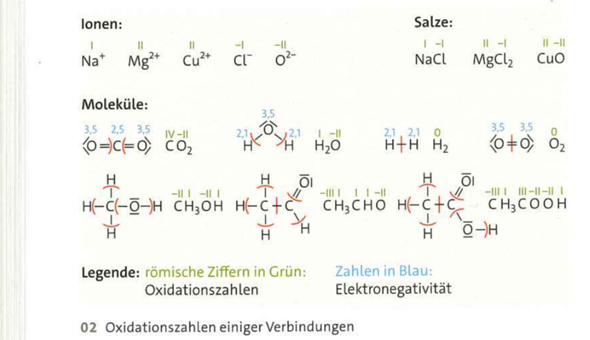
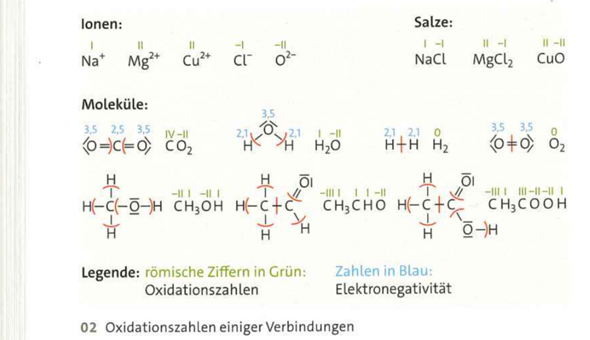
Oxidationszahlen?
Heyy,
wie bestimme ich die oxidationszahlen?

3 Antworten
Du schreibst die Lewis-Formel auf (also die Strukturformel plus einsame Elektronenpaare) und schlägst dann die Elektronegativitäen der Elemente nach: O > C > H.
Jetzt teilst Du alle bindenenden Elektronenpaare dem Atom mit der höheren Elektronegativität zu (bei Bindungen zwischen gleichen Atomen wird halbe–halbe geteilt). Dann zählst Du die Elektronen an jedem Atom ab und vergleichst mit der Elektronenanzahl im nackten Atom; die Differenz ist die Oxidationszahl. Natürlich zählen wir nur die Elektronen in der äußerste Schale (Valenzschale), nicht die inneren.
Als Beispiel nehmen wir das oberste C-Atom in Deiner Formel (die COOH-Gruppe): insgesamt 6 Elektronen stecken in den CO-Bindungen, die bekommt der elektronegative Sauerstoff zugeteilt. Die Bindung zum nächsten C wird halb–halbe geteilt. Also hat der Kohlenstoff der COOH-Gruppe in dieser Zählung nur ein Elektron; ein nacktes C-Atom hat vier Elektronen, also fehlen drei, also ist die Oxidationszahl +III.
Das nächste C-Atom bekommt beide Elektronen der C–H-Bindung zugerechnet, aber nicht die der C–O-Bindung; außerdem noch je ein Elektron aus den beiden C–C-Bindungen. Das macht insgesamt vier Elektronen, gleich viel wie im neutralen Atom, also Oxidationszahl 0.
Hast du doch schon? Für das C in der Mitte ist es 0.
Einfach die Elektronegativitäten aus dem Periodensystem ablesen und vergleichen. Der mit der höheren bekommt ein fiktives Elektron also -I und das andere Atom verliert eines also +I - das dann noch mit allen Bindungspartnern machen und verrechnen.
Siehe Wikibooks Anorganische Chemie für Schüler/ Redoxreaktionen als Elektronenübergänge
Oder hier aus dem Buch Fokus Chemie SII: