Oberflächenspannung und Dichteanomalie?
Hallo,
könnt ihr mir diese Fragen bitte beantworten?
1. Erkläre was Wasserstoffbrückenbindungen sind.
2. Erkläre was man unter der Oberflächenspannung des Wassers versteht.
3. Erläutere was man unter der Dichteanomalie des Wasser versteht und erkläre dieses Phänomen.
4. Wasser als Dipol. Wie kommen Ladungen im Wassermolekül zustande?
Lg
3 Antworten
Die Fragen beantwortet man am besten andersrum:
4) So sieht ein Wassermolekül schematisch aus:
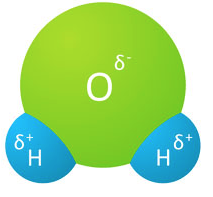
Die beiden Wasserstoffatome haben sich in einem Winkel an das Sauerstoffatom gebunden. Das Sauerstoffatom zieht die Elektronen aus der Wasserstoffhülle stark an sich, sodass die verschobenen Elektronen zu einer elektrischen Ladung führen. Auf der Seite der Wasserstoffmoleküle haben wir eine positive und auf der Seite des Sauerstoffatomes haben wir eine negative Ladung. Diese unterschiedlichen Ladungen nennt man Dipol.
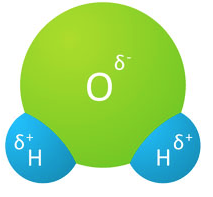
1) Nun ist es so, dass sich die positive und die negative Ladung benachbarter Wassermoleküle gegenseitig anziehen und eine Bindung herstellen. Das sieht dann so aus:
Diese Verbindung zwischen benachbarten Wassermolekülen wird Wasserstoffbrückenbindung genannt.
Kurzform: Unter Wasserstoffbrückenbindung versteht man die elektrische Anziehung der positiv geladenen Wasserstoffmoleküle und der negativ geladenen Sauerstoffmoleküle in benachbarten Wassermolekülen.
2) Da sich die Wassermoleküle miteinander elektrisch verbinden und das auch an der Oberfläche passiert, müssen die Wasserstoffbrückenbindungen aufgebrochen werden, um die Oberfläche des Wassers zu durchstoßen. Die Wasserstoffbrückenbindungen an der Oberfläche führen daher zu der Oberflächenspannung. Diese Oberflächenspannung ist so stark, dass Insekten auf der Wasseroberfläche laufen können, ohne einzusinken.
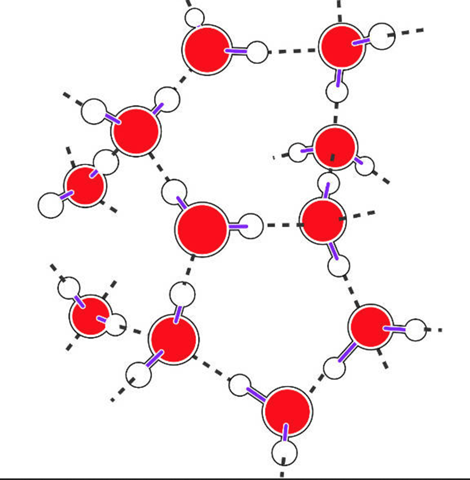
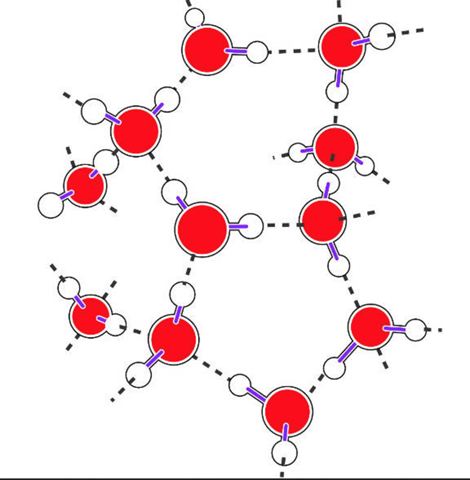
Zur Ergänzung:
Wasser besteht aus einem großen O-Atom und 2 kleinen H-Atomen, die in den Ecken eines (verzerrten) Tetraeders sitzen. Die beiden anderen Ecken werden von je einem Elektronenpaar besetzt.
Im Eis hat also eine große Sauerstoff Kugel vier nächste Sauerstoffkugeln, nämlich über H-Brücken (2 H sind die eigenen, 2 die der Nachbarn) gebundene. Das Ganze ist eine Packung, bei der die Nachbarn Tetraederstellen besetzen. Das ist eine ziemlich lockere Packung, denn wenn man gleich große Kugeln (Schrotkugeln, Tennisbälle was immer...) aufeinander stapelt und schüttelt, dann bilden sie eine dichteste Kugelpackung mit zwölf nächsten Nachbarn. Dichter geht nicht mehr.
Im flüssigen Wasser bildet sich dann die dichteste Packung.
Nebenbei haben auch andere Stoffe mit Tetraederstruktur im Gitter diese Anomalie z.B. Germanium.
Hausaufgaben mache ich dir nicht!
- Kannst du selbst herausfinden.
- Dasselbe wie (1), nur auf makroskopischer Ebene - Emergenz
- Festes Wasser hat eine geringere Dichte als flüssig. Das ist einzigartig. Und - Wasser hat sein Dichtemaximum bei 4° C.
- Schau dir die Molekülstruktur verglichen mit CO2 an.