intramolekulare Halbacetalbildung?
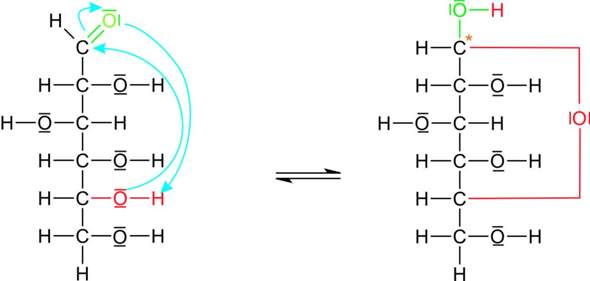
Ich habe gedacht, dass die OH-Gruppe am C5 ihr Proton abgibt, aber dass ich anscheinend falsch. Die freien Elektronen des O Atoms der OH- Gruppe binden anscheinend an die Carbonylgruppe. Ich verstehe es leider nicht ganz. Kann es mir jmd bitte erklären ?
Lg
3 Antworten
Ja, das ist eine „nukleophile Addition“: Der rote Sauerstoff, der ja eine negative Partialladung trägt, greift den Kohlenstoff an, der wegen des elektronegativen Sauerstoff-Nachbarn (grün) teilweise positiviert ist. Danach hüpft das H vom roten zum grünen Sauerstoff.
In der organischen Chemie gibt es Millionen solcher Reaktionsmechanismen, und das ist einer der einfachsten und grundlegendsten. Die Organiker haben da eine sehr robuste und hemdsärmelige Terminologie, oft mit gebogenen Pfeilchen, die angeblich anzeigen, was die Elektronen vermeintlich machen. Eine Freundin von mir hat das um Studium mal flapsig so kommentiert: In der Organischen Chemie geht es eh nur darum, ob der Sticki jetzt von links oder von rechts angreift.
Das ist eine simple Säure–Base-Reaktion: Nach dem Angriff des roten O und dem Ringschluß haben wir einen dreibindigen roten O (wie H₃O⁺) und einen einbindigen grünen O (so wie OH⁻). Und genauso wie H₃O⁺+OH⁻ zu zwei H₂O (mit zweibindigem O) reagieren, gibt es dann auch hier eine Art intramolekulare Neutralisationsreaktion.
ahh, also sodass das proton nur die reaktion ausgleicht ?
und ich habe noch eine andere Frage. Wieso genau passiert diese nucleophile Addition an dem C5 Atom und keinem anderem ? Es sind ja alle gleich aufgebaut ( außer C6 mit dem Rest)
Der Sauerstoff am C₅ tut sich am einfachsten, an den C₁ heranzukommen, weil dabei ein entspannter Sechsring entsteht. Fünfringe sind auch entspannt, und manche Zucker bilden daher auch cyclische Formen mit Fünfring (z.B. Fructose), vermutlich aus Gründen, die mit ein Details der räumlichen Struktur zusammenhängen. Dagegen sind Drei-, Vier- und Siebenringe bekannt dafür, daß sie sich nur ungerne bilden.
warum ist das rote O dreibändig und das grüne O einbindig ? Nimmt das rote dem grünen ein elektronenpaar weg, wenn es nucleophil am C angreift
Nach dem nukleophilen Angriff hast Du schon fast die Endstruktur, nur daß der Wasserstoff noch am roten O sitzt und nicht am grünen.
Beachte, daß die türkisen Pfeile nicht die Wanderung der Atome beschreiben, sondern die der Elektronen.
- Der Pfeil vom roten O zum Carbonyl-C bedeutet, daß das einsame Elektronenpaar des roten O eine Bindung zum Carbonyl-C eingeht (dadurch wird der rote O dreibindig),
- der Pfeil vom Carbonyl-C zum grünen O bedeutet, daß eine Komponente der Doppelbindung zu einem einsamen Elektronenpaar am grünen O wird, also wird der grüne O einbindg
- der letzte Pfeil vom grünen O zum roten H zeigt dann die Bindung an, die zwischen den beiden ausgebildet wird; dadurch wird der grüne O wieder zweibindig
- und eigentlich müßte noch ein weiterer Pfeil eingezeichnet werden: Das bindende Paar zwischen dem roten O und rotem H zieht sich zum roten O zurück, womit der rote O wieder zweibindig wird.
Elektronen als Pfeile zu schreiben, ist ein schräges Hobby der Organiker. Da ich selbst keiner bin, lächle ich nur milde darüber.
verste noch immer nicht ganz,weshalb das rote O plötzlich dreibändig ist nach der nucleophilen addition ? es greift ja mit seinem freuen elektronenpaar an, dann müsste er doch einbindig sein, Soher kommen die 2 weiteren Elektronenpaare ?
Da rote O ist an den C₅ gebunden und an den roten H. Mit seinem einsamen Elektronenpaar greift er den C₁ an und bildet eine Bindung zu ihm. Also hat er jetzt insgesamt drei Bindungen.
In der Organik kannst Du quasi alles über die Elektronegativität der beteiligten Elemente erklären: der doppelt gebundene Sauerstoff zieht die Bindungselektronen vom ab und läßt ein fast nackisches C übrig, das entsprechend nucleophol angegriffen werden kann - und das macht das freie Elektronenpaar der OH-Gruppe (-> ein 6-Ring wird gebildet) Und da der Sauerstoff auf seine volle Elektronenausstattung besteht, schmeißt er den Wasserstoff weg. Das zum Carbonyl-O hochgeklappte Elektronenpaar fängt ihn aber dankbar wieder auf.
Ein gutes Beispiel für einen recht schlecht ausgeführten Reaktionsmechanismus. Steht auf Wiki- oder Chemgapedia bestimmt ausführlicher und besser beschrieben. Ansonsten nimmt man den P. Sykes.
Sieh Dir einmal diesen Link an:
https://www.w-hoelzel.de/chemie/1-und-2-jahrgangsstufe/naturstoffe/041-halbacetalbildung
da hatte ich auch schon geguckt, aber habe es nicht verstanden
danke schonmal, aber mir ist noch nicht ganz klar weswegen das wasserstoffatom mitwandert