Warum stoßen sich Atome nicht ab?
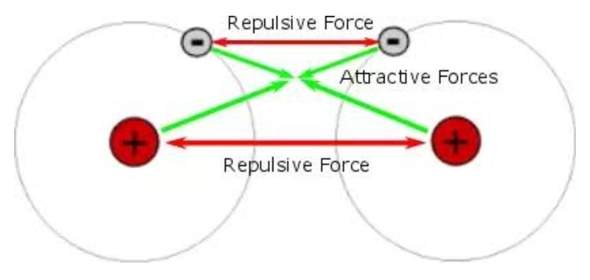
Warum ziehen sich zum Beispiel Wasserstoffatome aus weiter Distanz gegenseitig an?
Ist die coulombsche Kraft zwischen Proton und Elektron stärker als die zwischen Proton, Proton & Elektron, Elektron? Und warum ist bei näher Distanz dann irgendwann die Abstoßung dominant?
2 Antworten
Gravitation
Ich denke eher Richtung Molekülorbitaltheorie aber sicher bin ich mir nicht
Das nicht so direkt was mit coulombscher Abstoßung zu tun, wie man sich das immer vorstellt. Das liegt unter anderem daran, dass Elektronen und Protonen (vor allem Elektronen) keine definierten Teilchen sind, die sich an einem gewissen Ort mit einem gewissen Impuls aufhalten. Das ist eben nur für die Vorstellung einfacher.
Es sind quantenmechanische Objekte und eher als abstrakte Wahrscheinlichkeitswolke zu sehen. Stell dir die Interaktion mehr als ein Potential vor. Die Elektronen "fallen" bei Annäherung in eine Art energetischen Trichter, bedingt durch die Wechselwirkung ihrer Orbitale (was im Prinzip nichts anderes als Wahrscheinlichkeitsfunktionen sind) miteinander. Dabei wird Bindungsenergie frei, das ist die Triebkraft der Reaktion.
Diese Abstoßungskräfte zwischen Elektronen und Kernen untereinander gibt es natürlich nach wie vor (sie tragen unter anderem auch zur Sterik eines Moleküls bei). Diese, zusammen mit der oben erwähnten Anziehung definieren dann die Aufenthaltswahrscheinlichkeiten der Elektronen in den Molekülorbitalen.
Der Unterschied zur Vorstellung mit Wahrscheinlichkeiten zur altbekannten "Magnetvorstellung" ist, dass die Wahrscheinlichkeit der Elektronen in Kernnähe (oder auch in Nähe zu anderen Elektronen) zu sein, zwar gering ist, aber eben nicht null.
Hoffe, dass war einigermaßen verständlich formuliert. Ist dann doch etwas schwieriger zu beschreiben, als ich dachte.
Kurzer Nachtrag: Wenn dich das noch weiter im Detail interessiert, kann ich dir nur empfehlen, ein Buch zur Hand zu nehmen. Wikipedia ist zwar durchaus hilfreich, allerdings fehlt da immer so ein bisschen der übergeordnete Zusammenhang bzw der rote Faden sozusagen. Weiß nicht was so am geeignetsten für Einsteiger ist, aber versuchs vielleicht mal mit "Physikalische Chemie" von Peter Atkins.
So in etwa. Diese Potentialtiefe wird zwischen den Kernen (Form und Abstand in Abhängigkeit von der Art des Orbtials) gebildet. Diese Potentialtiefe existiert aber nur für bindende Orbitale und dann auch in verschiedenen Tiefen.
Antibindende Orbitale haben keine solche Potentialtiefe und wirken daher ausschließlich abstoßend. Bei den Edelgasen wären auch die antibinden Orbitale besetzt. Insgesamt überwiegt daher bei Edelgasen die Abstoßungskraft. Das Atom erzielt damit keinen energetischen Vorteil aus der Bindung, im Gegenteil.
Kann es sein, dass ich die "London Kraft" die dafür sorgt, dass Atome sich am Anfang annähern mit "Bindung eingehen" vermische? 😅
"Also kann ich mir einfach vorstellen, dass dadurch, dass die Elektronen in s,p orbitalen durch die Verteilung um den Kern eine viel geringere Ladung zur hingerichteten Seite haben und deswegen die Elektronenwolken zwischen Atomen sich viel weniger voneinander abstoßen als die konzentrierte Anziehung vom Kern die auf die Wolke wirkt?" - Ist das nicht einfach durch diese London Kraft?
Ein bisschen vielleicht, aber die einfache Vorstellung für uns funktioniert in beiden Fällen ähnlich. Nur dass es da eben nur um Ladungsverschiebung und elektrische Felder geht. Molekülorbitale sind dann doch noch etwas komplizierter zu beschreiben.
Aber wie gesagt, ich kann dir da wirklich nur ein Buch ans Herz legen. Da ist es sehr viel genauer und ausführlicher erklärt, als ich es hier je könnte.
Ich schau gleich mal im aktins nach, der steht zum Glück hinter mir, danke!
Also kann ich mir einfach vorstellen, dass dadurch, dass die Elektronen in s,p orbitalen durch die Verteilung um den Kern eine viel geringere Ladung zur hingerichteten Seite haben und deswegen die Elektronenwolken zwischen Atomen sich viel weniger voneinander abstoßen als die konzentrierte Anziehung vom Kern die auf die Wolke wirkt? Was ich mich jetzt noch Frage ist, wenn also 2 Atome nahe genug kommen, zieht der Kern die Elektronenwolke an, so das die Elektronenwolken sich in den Bereich zwischen den Kernen ziehen, bis die Abstoßung zwischen den Kernen überwiegt und sich ein Gleichgewicht einstellt (lennard Jones potentialtiefe), warum ziehen sich eigentlich Edelgase mit s2p6 Konfiguration nicht genauso an?