Hilfe bei Chemie Oberstufe?
Kann mir bitte jemand bei der 3.2 helfen? Ich kriege die Einheit einfach nicht normal hin, wie man es bei Kc eigentlich hat.
Als Foto habe ich das Arbeitsblatt angefügt und meine Lösung zur 2), die man ja benötigt für die 3.2.
Ich sitze da wirklich schon seit 2h dran und ich wäre unglaublich dankbar, wenn jemand die Aufgabe knackt. Vielen Dank im Voraus!


2 Antworten
Als erstes rechnen wir Aufgabe 2:
2 SO₂ + O₂ ⟶ SO₃
Da unter den Reaktionsbedingungen alle Stoffe Gase sind, bekommt man für Kₚ

und das kann man natürlich auch noch in eine andere Einheit umrechnen, z.B 3.43 bar⁻¹ oder 3.43⋅10⁻⁵ Pa⁻¹. Das hast Du auch richtig hingekriegt.
Jetzt sollst Du dasselbe mit Konzentrationen manchen. Wir reden von Gasen, da gilt pV=nRT, außerdem ist c=n/V. Wir bekommen also schmerzlos c=n/V=p/(RT), und das gilt natürlich separat für jede Komponente. Du könntest jetzt alle drei Drücke in Konzentrationen umrechnen, unter Berücksichtigung daß RT bei 200 °C 3934 J/mol beträgt. So erhältst Du c(SO₃) = p(SO₃)/(RT) = 33500 Pa / 3934 J/mol = 8.52 mol/m³ = 0.00852 mol/l etc. und brauchst nur einzusetzen.
Glatter geht es aber folgendermaßen:

Um Ärger mit den Einheiten aus dem Weg zu gehen, nehmen wir das Kₚ in SI-Einheiten: 3.43⋅10⁻⁵ Pa⁻¹ / (3934 J/mol) = 8.73⋅10⁻⁷ m³/mol = 8.73⋅10⁻⁴ l/mol. Wenn man links SI-Grundeinheiten einsetzt, kommen rechts auch wieder welche heraus.
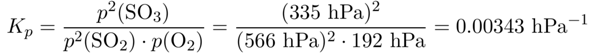
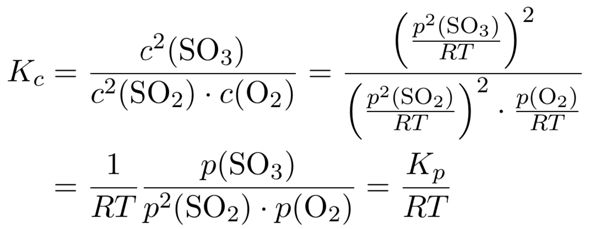
Ich habe blind SI-Grundeinheiten eingesetzt (Pa, J). Dann weiß ich, daß ich eine SI-Grundeinheit (mol/m³) herausbekomme.
Aber Du kannst es natürlich auch in Einzelschritten selber herleiten. Dabei hilft es zu wissen, daß Nm=J:
Pa mol / J = N/m² ⋅mol/J = J/m³ ⋅ mol/J = mol/m³
Sobald Du anfängst, irgendwelche anderen Einheiten (hPa, dm³, kJ) einzusetzen, wird es gewöhnlich messy. Mit Glück kürzt es sich später immer noch heraus, aber auf dem Weg dahin müssen viele Exponenten herumjongliert werden, und dabei gibt es viele Möglichkeiten, auf der Nase zu landen.
Bei der Berechnung von Kp müssen natürlich auch die Zahlenwerte mit den entsprechenden Exponenten versorgt werden, nicht nur die Einheiten. Bei dem SO2/SO3-Gleichgewicht erhält man als Einheit für Kp bei den gegebenen Einheiten:
hPa²/(hPa² * hPa) ==> 1/hPa
Das habe ich ja so bei Kp, aber mit bar anstelle von hPa, das macht aber nicht den Unterschied oder? Ich will ja bei der 3.2 Kc berechnen anhand von Kp
Erstmal Dankeschön! Eine Nachfrage:
,,So erhältst Du c(SO₃) = p(SO₃)/(RT) = 33500 Pa / 3934 J/mol = 8.52 mol/m³ = 0.00852 mol/l etc. und brauchst nur einzusetzen.“
Wie bist du hier auf mol/m3 gekommen? Ich hab heute lange mit den Einheiten gekämpft. Da sollte doch 8,52 Pa/J/Mol rauskommen, wenn man einsetzt. Wie kommt man dann auf mol/L bzw. mol/m3?