Frage zu pKs?
Kann mir jemand bei der Zuordnung helfen? Ich kenne nur die Darstellungen, bei denen die Y-Achse den pH-Wert angibt. Was soll das mit dem Dissoziationsgrad sein? Kann man den pKs hier gleich ablesen?

1 Antwort
Du siehst hier den Dissoziationsgrad einer Säure als Funktion der Verdünnung. Die Verdünnung ist logarithmisch aufgetragen (c₀=10¯ˣ mol/l), und der Dissoziationsgrad liegt naturgemäß immer zwischen 0 und 1: Er ist ja definiert als jener Anteil der Säure, der die Dissoziation eingeht: α = c(A¯)/jc₀ = c(A¯) / [ c(HA)+c(A¯) ] :
HA + H₂O ⟶ A¯ + H₃O⁺
Man kann das Massenwirkungsgesetz formulieren und nach α auflösen:

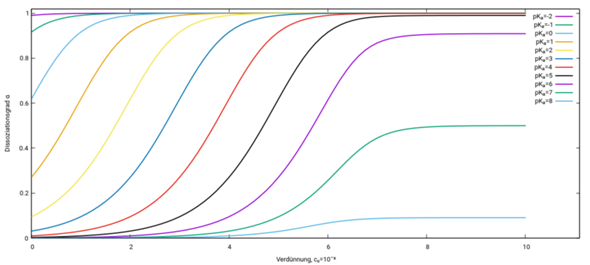
Dabei ist die Autoprotolyse nicht berücksichtigt (es wird die Näherung c(H₃O⁺)=c(A¯) gemacht), die Formel versagt also wenn pH≈7 und pKₐ⪆7. Man kann die Formel um diesen Effekt bereinigen, aber dann wird sie viel komplizierter. Ich schreib das hier nicht auf, aber plotte dafür die Graphen für die pKₐ-Werte von −2 bis +8:

Starke Säuren (pKₐ≪0) sind bei allen Konzentrationen nahezu vollständig dissoziiert, sehr schwache Säuren (pKₐ≫7) dissoziieren überhaupt nicht, und im pKₐ-Bereich dazwischen ist es konzentrationsabhängig, mit 50% Dissoziation bei c₀=2Kₐ bzw. −lg(c₀)=pKₐ−lg(2)≈pKₐ−0.3
In Deiner Graphik sollst die die Säuren den Kurven zuordnen. HClO₄ und HCl sind beide sehr stark, also werden sie durch die Kurve (a) beschrieben. Die nächststärkere Säure ist HNO₃, immer noch recht stark (b), dann kommen in der Reihenfolge der pKₐ-Werte HClO₂, HF, CH₃COOH, HClO und zuletzt HCN, die gar nicht mehr dissoziiert (also α≈0 bei jeder Konzentration, Kurve (g) ganz am Boden).
P.S.: Zwei Hirnfürze korrigiert.
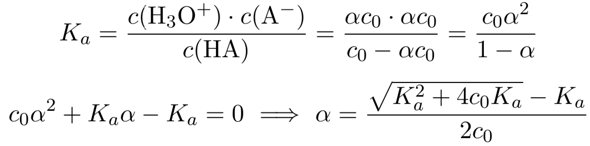
Oh, ich habe deine Antwort völlig übersehen. Tausend Dank!!! Ich bin wirklich sehr dankbar, hast du eine derart ausführliche Erklärung geliefert <3