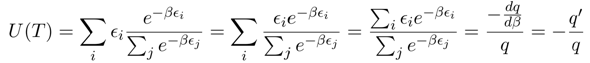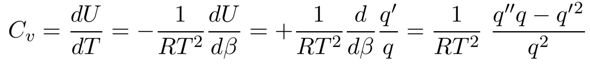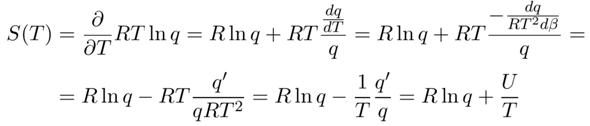Wie werden Zustandsfunktionen in der statistischen Thermodynamik berechnet?
1 Antwort
Aus der Zustandssumme q(β) = ∑ exp(−βεᵢ) wobei β=1/(RT). Dazu muß man natürlich wissen, wie die Energieniveaux εᵢ für das System aussehen; oft verwendet man ein Modell, das sich geschlossen summieren oder integrieren läßt, z.B. einen harmonischen Oszillator, oder man bastelt sich Zustandssummen aus verschiedenen Modellen zusammen. Irgendein Ausdruck, im schlimmsten Fall eine numerische Tabelle, muß aber bekannt sein.
Im folgenden nehme ich an, daß wir vom kanonischen Ensemble reden, also bei konstantem Volumen, konstanter Temperatur und konstanter Teilchenzahl arbeiten. In diesem Fall ist die freie Energie einfach das thermodynamische Potential, F=−RTln(q).
Der Anteil der Moleküle mit Energie εᵢ ist ja einfach exp(−βεᵢ)/q, und die innere Energie bekommt man daher ganz leicht als mit den Besatzungsanteilen gewichtete Summe aller Energieniveaux. Dabei bemerkt man, daß der Ausdruck im Zähler genau die Ableitung des Nenners ist, und kommt daher zu einem kompakten Endergebnis (dabei bedeutet q’ natürlich die Ableitung von q nach β).

Daraus kriegt man sofort die Wärmekapazität als dU/dT, dabei nutzt man aus daß dβ/dT=−RT² und daraus dT=−RT²dβ; dann braucht man nur noch die Quotientenregel.

Für die Entropie wissen wir, daß sie das partielle Differential S=−∂F/∂T ist, weil das totale Differential der freien Energie dF = −S dT − p dV lautet. Das setzen wir einfach ein:

Das sieht deutlich schlimmer aus, als es ist: Wir wollen RTln(q) nach T ableiten, und da q selbst temperaturabhängig ist, brauchen wir zuerst die Produktregel, dann die Kettenregel. Dann wechseln wir wieder geschickt von dT nach dβ und bekommen dann wieder das gewöhnlich q’=dq/dβ, das wir mit dem Ausdruck für die innere Energie von oben in Verbindung bringen.
(Wenn Du Physiker bist, dann darfst Du natürlich auch die Boltzmannkonstante statt der Gaskonstanten verwenden — Chemiker wie ich denken lieber in Energien pro Mol statt Energien pro Teilchen)
Vorzeichenfehler und andere Schludereien sind wie immer vorbehalten.