Wie Protonen / Neutronen / Elektronen Anzahl eines Elements "errechnen"?
Nehmen wir mal Chlor im Periodensystem. Dritte Periode, siebte Hauptgruppe. Okay. Jetzt muss ich anhand diesem Mist die Protonen / Elektronen / Neutronen rausfinden. Könnt ihr mir das anhand dem Beispiel mal erläutern ? Google & Wikipedia hat mich nicht weitergebracht.
Dankeschöön.
7 Antworten
Die Ordnungszahl ist die Anzahl der Protonen. Und genausoviele Elektronen hat das Atom.
Nun ist die Masse wichtig. Ein Teilchen im Atomkern wiegt 1 unit. Im Atomkern hast du ja Protonen und Neutronen. Und wenn du nun die Atommasse nimmst also die Anzahl der units, und davon die Anzahl der Protonen abziehst, hast du die Anzahl der Neutronen raus.
Nun gibt es ja neben der Ordnungszahl auch die Massenzahl. Durch Angabe dieser beiden Zahlen kann ein Isotop eindeutig bestimmt werden. Beispiel 16 8 O (16 klein links hochgestellt, 8 klein links tiefgestellt). Das meint ein Sauerstoffatom mit 16 Hadronen (Protonen + Neutronen, Massenzahl), von denen 8 Protonen (Ordnungszahl) sind.
Naja du mußt bedenken, daß es immer mehrere Isotope gibt. Deshalb ist die Atommasse auch keine ganze Zahl, sondern immer eine Dezimalzahl. Also der Duchschnittswert, den das Element hat. Die Anzahl der Protonen ist immer gleich, wenn es eins mehr oder weniger wäre, wäre es ein anderes Element. Und die Anzahl der Elektronen eines Elementes ist immer gleich der Anzahl der Protonen, sonst wäre es kein elementarer Stoff, sondern ein Ion. Und die Anzahl der Neutronen kann abweichen. Aber wenn du für die Berechnung der Masse einfach das nimmst, was im Periodensystem steht und auf eine ganze Zahl rundest, kommst du auf die Anzahl der Neutronen, die das Element am häufigsten hat. Das gilt für alle Elemente.
Was heißt da Mist??
Das Periodensystem ist der größte Spickzettel aller Zeiten. darauf ist fast alles geballt, was man so wissen kann.
Protonenzahl und damit auch reguläre Elektronenanzahl wird durch die Reihenfolge im PSE eindeutig gezeigt. Element Nummer 8 hat 8 Protonen und Element Nummer 76 eben 76.
Die Neutronenzahl ergibt sich aus der Masse (das ist die größere zahl, oft doppelt so groß). Masse - Protonenzahl = Neutronezahl (natürlich gerundet).
Doch, auch wenn es vielleicht fachlich nicht ganz perfekt ausgedrückt ist, ist es inhaltlich richtig, was Zagdil sagt.
Wenn ich mir jetzt hingegen deine Antwort angucke(Hukii)... Irgendwie hast du die Frage wohl nicht verstanden. Du antwortest jedenfalls nicht auf das, was gefragt wurde ;)
Also, da das Element in der 7. Hauptgruppe und der 3. Periode ist, weißt Du, dass es fast eine Edelgaskonfiguration hat, das heißt, es muss 17 Elektronen haben, davon 7 auf der äußersten Schale. Du kennst ja bestimmt das mit den K L M N O P Schalen und so. Jede Periode verkörpert sozusagen eine. Und die Protonen sind ja gleich der Anzahl der Elektronen (es sei denn es ist ein Isotop). Bei Neutronen kann ich nicht weiterhelfen :(
DAS wiederrum ist völlig falsch.
Ein Isotop hat nichts mit Elektronen zu tun, sondern mit unterschiedlichen Massen bei gleichen Protonenzahlen (also unterschiedliche viele Neutronen).
Die Ordnungszahl gibt wiederrum direkt auf einen Blick die Protonenzahl an, ein rumrechnen über Schalen, Edelgaskonfiguration und dann die Elektronen ist völlig unnötig.
MFG
Hallo, du gehst die Sache etwas zu kompliziert an. Die Frage von BiTEvnss war wesentlich einerfacher als das, was du hier erzählst. Es ging gar nicht um die Verteilung der Elektronen und die Oktetregel usw. (abgesehen daß du da auch nicht alles richtig erklärt hast). Es geht nur darum, wenn ein Element vorhanden ist, wie man aus dem Periodensyste abliest, wieviele Protonen und Elektronen vorhanden sind und wie mann ausrechnet, wieviele Neutronen vorhanden sind. Siehe dazu meine Antwort oder auch die vo Zagdil, die du als völligen Quatsch hinstellen wolltest ;)
Die maximalen Elektronen auf den äßersten Schalen sind: K = 2
L = 8
M = 8
N = 18
O = 18
P = 32
q = 32
mit Beispiel:
die Ordnungzahl ist die Anzahl der Protonen
Neutronenzahl ist die Masse, hier 35,45 minus Ordnungszahl. Die Masse ist ein statistischer Wert. BEim Chlor liegen die Isotope mit 18 Neutronen ungefähr gleich oft vor wie die mit 19, weshalb die durschnittliche Masse 35,45 beträgt.
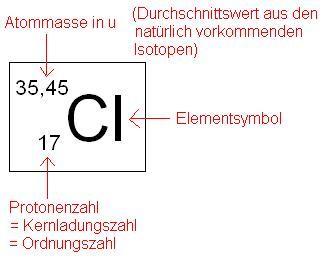
du hast die ordnungs zahl, bei chlor 17-also 17 protonen(und damit 17 elektronen)
dann kannste aus der differenz zum atomgewicht die anzahl an neutronen errehcnen
außerdem: 3. periode (also zeile)=3 schalen
und hauptgruppe 7=7 außenelektronen
daraus kannste dir auch die gesamtanzahl errechnen
super antwort! Danke! Und da gibt's bei keinem Element eine Ausnahme?