Chemie Periodensystem der Elemente?
Hallo,
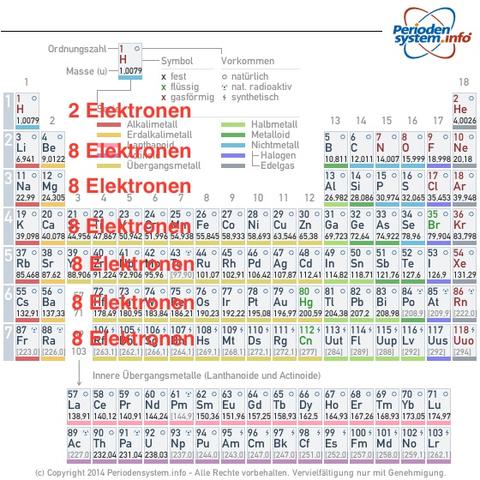
habe eine Frage zu den Protonen, Neutronen und Elektronen im PSE. Wenn ich das Element Zink mit einer Massenzahl von 64 und einer Ordnungszahl von 30 habe, wie berechne ich dann die Anzahl der Elektronen. Ich weiß das auf der innersten Schale 2 Elektronen passen und auf der äußersten so viele wie die Hauptgruppe, also hier wieder 2. Jetzt gibt es ja noch die mittleren Schalen, auf die jeweils 8 Elektronen passen - bloß wie viele Schalen sind das? Ich habe in dem Bild mal dran geschrieben so wie ich es denke, dann würde ich ja auch insgesamt 20 Elektronen kommen - 2 Stück innere Schale + 8 Stück erste mittlere Schale + 8 Stück letzte mittlere Schale + 2 Stück äußere Schale. Protonen hat es ja 30 Stück, also ist ein eindeutiger Unterschied vorhanden...
Danke für eure hilfreichen Antworten.
3 Antworten
+10 für die d-Schale und du kommst bei 30 an.
1s^2 2s^2 2p^6 3s^2 3p^6 3d^10 4s^2 ist die Elektronenkonfiguration von Zink.
Danke für deine Antwort, davon verstehe ich allerdings nichts...
Warum 10 Elektronen für die "D-Schale"???
neutronen hat es ja 34 Stück?
Um es noch mal deutlich zu sagen, du darfst Periode und Schale nicht durcheinander bringen.
Die Periode gibt nur an, welche Schale neu angefangen wurde, aber nicht, an welchen Schalen "gearbeitet" wird.
Die maximale Anzahl der Elektronen in Schale x ergibt sich zu 2 x². Also
- Schale: 2 Elektronen
- Schale: 8 Elektronen
- Schale: 18 Elektronen
- Schale: 32 Elektronen
- Schale: 50 Elektronen
- Schale: 72 Elektronen
- Schale: 98 Elektronen
Allerdings werden die Schalen nicht der Reihe nach aufgefüllt, sondern nach sehr speziellen Regeln mit noch spezielleren Ausnahmen.
Das kannst du schon daran sehen, dass es überhaupt mehr als 5 Perioden gibt. Denn bei "sauberem" Auffüllen würde nicht mal die 5 Schale voll werden, weil es keine (stabilen) Kerne mit 2+8+18+32+50=110 Protonen gibt.
Die Regeln kann man eigentlich nur lernen, wie auch die Untergruppen der Orbitale, die sich über ihre Form definieren, die erwähnten s-, p-, d- und f-Orbitale. Da suchst du am besten nach Bildern.
Protonen und Elektronen hat es immer gleich viele also jeweils 30 in diesem Fall.
Die Anzahl der Schalen kannst du an der Periode erkennen (Wenn du das System von oben nach unten ließt). Bei Zink also 4.
okay danke. Und haben dann die anderen in der Reihe alle 30 Elektronen?!
K-Schale maximal 2 + L-Schale maximal 8 + M-Schale maximal 18 + (N-Schale maximal 32) bei Zink werden jedoch nur 2 besetzt da es insgesamt nur 30 Elektronen hat.
Um es noch einmal mit meinen Worten wiederzugeben hat die innerste Schale Platz für 2 Elektronen, die zweite Platz für 8, die danach Platz für 18 Elektronen?
Könntest du vielleicht auch noch schreiben wie man dann auf 30 kommt? Danke schon mal!
Im Prinzip kannst du einfach durchzählen, wenn du der Ordnungszahl nicht glaubst.
2 in der ersten Periode
8 in der zweiten Periode
8 in der dritten Periode
12 in der vierten Periode
2+8+8+12 = 30
Ja könnte ich machen, verstanden habe ich das dann leider aber nicht.
Bei den ersten drei Schalen kann ich dir folgen, bei der vierten allerdings nicht mehr, warum kommst du auf 12? Es sollen doch nur 2 auf der äußeren Bahn sein - soweit ich es jetzt verstanden habe...
Hm... wie erklärt man das am besten, ohne vom Schalen Modell abzuweichen? Ich versuche dir das mal zu erklären, ohne deinem Chemielehrer zu sehr auf die Füße zu treten, denn eigentlich ist das ganze viel komplizierter, als ihr das lernt (was aber gut ist, denn so komplizierten Mist muss man erst im Chemiestudium bzw. in der Oberstufe im Chemieleistungskurs lernen):
Du kannst dir das vielleicht so vorstellen, dass in der 4. Periode Kalium und Calcium anfangen ihre äußere Hülle zu füllen. Mittlerweile ist das Atom mit der äußersten Hülle aber schon so groß, dass es aus komplizierten Gründen plötzlich energetisch günstiger ist, eine neue Schale anzufangen (Atome möchten immer eine so niedrige Energie wie möglich haben). Das sind die Nebengruppenelemente von Scandium bis Zink.
Wenn die ihre ihre "äußere" Schale voll haben mit 10 (!!) Elektronen, wird der Rest der vorhin abgebrochenen Schale gefüllt (Gallium bis Krypton). Du hast dann also die zwei Elektreonen von Kalium und Calcium, sowie die 10 Elektronen der Nebengruppenelemente.
Du merkst, dass die 8er Regel in der 4. Periode nicht mehr gilt. Darum ist dein Bild auch nicht ganz korrekt. In der 4. und 5. Periode kommen nämlich jeweils 18 Elektronen dazu. In der 6. und 7. sogar 32.
ich hoffe das ich das jetzt richtig verstanden habe. Ich weiß jetzt zumindest wie ich auf die 30 Elektronen komme :D
Kannst du denn auch erklären wie ich auf die 27 Elektronen bei Cobalt komme? Ich meine eigentlich dürfe sich an der Rechnung nichts ändern, da ja beide in der 4 Periode liegen und in Hauptgruppe 2... oder muss ich hier immer ein Elektron abziehen, wenn ich mich weiter in Richtung Hauptgruppe 1 begebe?
Exakt :) die Elektronen versuchen so nah wie möglich um den Kern zu kreisen. Demnach füllen sie die offenen "Plätze" der Schalen von innen nach außen auf (so kannst du es dir vorstellen).