Puffer oder nicht?
Können 0,1 M H2SO3 und 0,2 M KHSO3 einen Puffer bilden?
2 Antworten
Ja, das ist ein Puffer, weil die Lösung aus einer Mischung eines Paares konjugierter Säure (SO₂) und Base (HSO₃⁻) besteht:
SO₂ + 2 H₂O ⟶ HSO₃⁻ + H₃O⁺ pKₐ=1.9
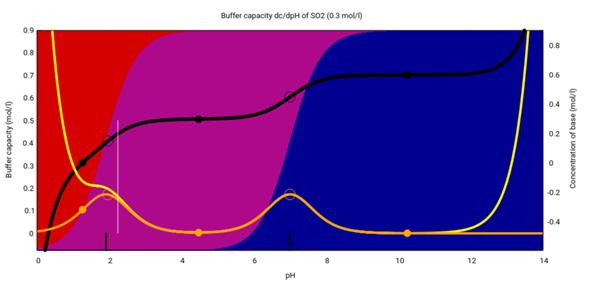
Für den pH dieser Pufferlösung bekommt man den Wert 2.24, wenn man es anständig rechnet (mit der Henderson–Hasselbalch-Gleichung sind es leicht abweichend 2.08). Um genauer zu verstehen, was die Lösung kann, und warum, und was nicht, und warum nicht, sehen wir uns das folgende Diagramm an, das das Verhalten von SO₂, HSO₃⁻ und SO₃²⁻ über den ganzen pH-Bereich darstellt. Es bezieht sich auf eine 0.3 mol/l Lösung, d.h., für jeden pH gilt daß alle Schwefelspezies (freies SO₂, Hydrogensulfit und Sulfit) zusammen auf 0.3 mol/l kommen:

Für jeden pH-Wert (x-Achse) siehst Du:
- Die Zusammensetzung der Lösung (Hintergrundfarben, rot=SO₂, violett=HSO₃⁻ und blau=SO₃²⁻)
- Die schwarze Kurve sagt Dir, wieviel Base (oder, falls negativ, Säure) Du brauchst, um eine 0.3 mol/l Lösung von SO₂ auf genau diesen pH zu bringen.
- Die orange Kurve zeigt die Pufferkapazität der Schwefelspezies bei diesem pH, die gelbe zeigt die Gesamtpufferkapazität der Lösung, unter Berücksichtigung von H₃O⁺ und OH⁻; die beiden Kurven weichen also nur an den Rändern voneinander ab, weil dort eine der beiden H₃O⁺ oder OH⁻ in hoher Konzentration vorliegt.
- Die schwarzen Striche am unteren Rand zeigen die pKₐ-Werte an. Man sieht deutlich, daß die Lösung um die pKₐ-Werte herum puffert.
- Der weiße Strich zeigt Deine Lösung, denn er trifft die schwarze Kurve beim Wert 0.2 mol/l (Du hast ja 0.1 mol/l SO₂ und 0.2 mol/l HSO₃⁻ in der Suppe, entsprechend einer Zusammensetzung 0.3 mol/l SO₂ + 0.2 mol/l NaOH).
- Der weiße Strich schneidet die Pufferkapazitätskurve nicht am Maximum, aber doch nicht weit daneben. Du siehst, daß die Lösung passabel gut puffert.
- Da der pH schon recht eng am Rand liegt, stimmen die Pufferkapazität der Schwefelionen und die der Gesamtlösung nicht mehr ganz überein. Aus demselben Grund kann auch die Henderson–Hasselbalch-Gleichung den pH der Mischung nur ungefähr voraussagen.
Ja, die beiden Substanzen bilden zusammen ein Puffersystem.
(1) Eine schwache Säure zusammen mit ihrer konjugierten Base, das passt genau.
(2) Die Konzentrationen sind ähnlich genug, so dass der Puffer funktionieren wird.
Der pH-Wert des Puffers liegt beim pKS-Wert der schwachen Säure, also hier etwa 1.9.