Phosphor negativ geladen?
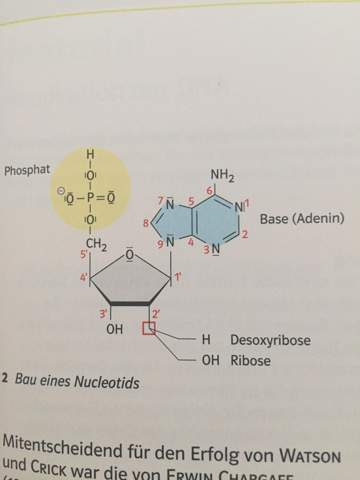
Warum ist das phosphor in diesem fall nicht negativ geladen ? Es hat doch 2 elektronen zu viel und entspricht nicht mehr der oktettregel ? und warum ist er 5bindig ?
4 Antworten
Weil die Oktettregel nur eine Veranschaulichung ist, die zwar beim Großteil ziemlich gut funktioniert, aber eben nicht der Realität entspricht.
Der Phosphor hier ist zb Überbleibsel von Phosphat, bzw Phosphorsäure. Da haben wir ionische Bindungen, da kann man nur beschränkt mit der Oktettregel, bzw Edelgasregel arbeiten.
Die Wirklichkeit kann besser beschrieben werden durch das Orbitalmodell- aber das ist so kompliziert, das wird im Leistungskurs Chemie kurz angeschnitten für Benzol, sonst ist es nicht Teil der Schulchemie. Viele Chemiker fangen damit auch kaum was an, verstehen es auch kaum außerhalb von Wasserstoff...
Behalts nur im Hinterkopf: Die Oktettregel ist eine Vereinfachung, eine Veranschaulichung. Es gibt Ausnahmen, die man nur damit nicht erklären kann.
Also Orbitalmodell ist klar besser, aber das braucht man hier nicht. Die Oktettregel gilt hier auch.
Übrigens hat Phosphorsäure keine ionischen Bindungen. Stark polar, ja, aber sicher nicht ionisch. Dafür reicht die EN-Differenz bei weitem nicht.
Keine Regel ohne Ausnahmen... Ab der dritten Periode ist das eher eine unverbindliche Option.
Sagt dir Orbital was? Sonst wird es kompliziert zu erklären.
1. Periode : 1 * 1s = maximal 1 Orbital = maximal 1 Bindung
2. Periode : 1 * 2s + 3 * 2p = maximal vier Orbitale = maximal vier Bindungen = maximal 8 Elektronen -> Oktettregel
3. Periode : 1 * 3s + 3 * 3p + 5 * 3d = maximal neun Orbitale = maximal neun Bindungen = maximal 18 Elektronen -> 18 Elektronenregel
Zeig mir mal ein Element aus der dritten Periode, das 9 Bindungen eingeht...
Für die Hauptgruppenelemente der dritten Periode gilt immer noch die Oktettregel.
Und die 18 Elektronen Regel gilt für Übergangsmetallkomplexe, nicht für Hauptgruppenelementverbindungen und selbst da nicht mal immer.
Die Oktettregel wird hier nicht verletzt
Phosphor hat 5 Valenzelektronen. Um die Oktettregel zu erfüllen muss er 3 Elektronen aufnehmen. Oder eben 5 abgeben. Das ist hier der Fall. Sauerstoff ist wesentlich elektronegativer als Phosphor. Die Elektronen der Bindungen werden also dem Sauerstoff zugesprochen. Bei 5 Bindungen mit den Sauerstoffatomen hat Phosphor daher 5 Elektronen weniger und damit die Elektronenkonfiguration von Neon. Oktettregel erfüllt.
Phosphor hat die geringere Elektronegativität. Die Elektronen werden hauptsächlich den Sauerstoffatomen zugeschrieben. Phosphor besitzt grob gesagt nur ein Elektron pro Bindung, somit 5.
Phosphor besitzt hier gar keine Valenzelektronen mehr, die werden alle den Sauerstoffatomen zugesprochen.
ja, ich weiß, dass es s,d,p und f- orbitale gibt. In jedes Orbtal passen 2 elektronen. Beispielsweise sind die elektronen von fluor in 2 s-Orbitalen und in 3 p-orbitalen