Ionenbildung im Modell?



Hallo Leute,
Und zwar verstehe ich diese Aufgaben nicht könnte mir jemand vllt. Helfen? Ich war 4 Monate in der Klinik und muss den Stoff nachholen und das Thema verstehe ich irgendwie gar nicht, würde mich sehr über eure Hilfe freuen!
1 Antwort
Hallo Nurrr13,
ein Ion ist ein Teilchen mit Ladung. Normalerweise besitzen Atome in ihren Hüllen genauso viel Elektronen wie Protonen im Kern. Sie sind elektrisch neutral geladen. Besitzen sie nun eine Ladung, indem sie ein zusätzliches Elektron aufnehmen oder abgeben, dann bezeichnet man sie als Ion. Ein Ion besitzt also eine andere Anzahl von Elektronen in der Hülle, aber an der Zahl der Protonen ändert sich nichts.
Hier ist einmal die ausgefüllte Tabelle für die Ionen der Nichtmetalle (ich kann keine Flüchtigkeitsfehler ausschließen!):
------------------------------------------------------------------------------------------------------------
Atom | Anzahl | Ladung | Ion .................| Anzahl | Ladung
..........| p+ | e- |................ | .......................| p+ | e- |
------------------------------------------------------------------------------------------------------------
Chlor |17; 17 | 0...............|Chloridion .....|17; 18 | 1-
------------------------------------------------------------------------------------------------------------
Schwefel |16; 16 | 0 .........|Sulfidion....... |16; 18 | 2-
------------------------------------------------------------------------------------------------------------
Fluor |9; 9 | 0..................... | Fluoridion ....|9; 10 | 1-
------------------------------------------------------------------------------------------------------------
Brom |35; 35 | 0................. | Bromidion... |35; 36 | 1-
------------------------------------------------------------------------------------------------------------
Phosphor |15; 15 | 0.......... | Phosphidion |15; 18 | 3-
------------------------------------------------------------------------------------------------------------
Stickstoff |7; 7 | 0.............. | Nitridion....... |7; 10 | 3-
------------------------------------------------------------------------------------------------------------
Iod |53; 53 | 0..................... | Iodidion ........|53; 54 | 1-
------------------------------------------------------------------------------------------------------------
Sauerstoff |8;8 | 0 ..............| Oxidion ..........|8; 10 | 2-
------------------------------------------------------------------------------------------------------------
Reaktionsgleichungen für die Bildung der Anionen:
Chlorid:
Sulfid:
Fluorid:
Bromid:
Phosphid:
Nitrid:
Iodid:
Oxid:
------------------------------------------------------------------------------------------------------------
Du siehst, dass die elektrische Ladung der Atome immer 0 ist. Das ist immer so, da man ja genauso viele Elektronen wie Protonen hat. Du siehst auch, dass die Anzahl der Protonen eines Ions, immer genauso groß ist, wie die Zahl der Ionen des jeweiligen Atoms. Das macht ja Sinn, da wir gesagt haben, dass sich beim Ion die Elektronenzahl ändert, aber nicht die Protonenzahl.
Wir gucken uns mal den Schwefel an.
Dieser besitzt 6 Außenelektronen (er steht in der 6. Hauptgruppe). Es wäre für ihn nun günstig 2 weitere Elektronen aufzunehmen, da er dann 8 Außenelektronen besäße und damit die Oktettregel erfüllt wäre. Beim Sulfidion ist genau das der Fall. Das Sulfidion besitzt nun 2 Elektronen mehr, als der Schwefel. Damit ist die Ladung vom Sulfidion "2+".
Bei Phosphor ist das anders: Er hat nur 5 Außenelektronen und im Phosphidion nimmt er nun 3 weitere Elektronen auf.
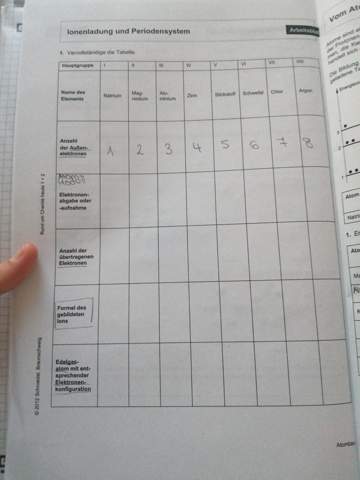
Jetzt versuch dich einmal selber an der anderen Tabelle. Dort sind jetzt keine Nichtmetalle eingetragen, sondern Metalle. Metalle treten oft als Kation auf, d.h. sie nehmen keine weiteren Elektronen auf und werden zum negativ geladenen Anion, sondern sie geben nun Elektronen ab und werden zum positiv geladenen Kation.
Beispiel: Magnesium, es hat als Atom 12 Protonen und 12 Elektronen und ist daher natürlich wieder neutral geladen. Als Ion hat es nur noch 10 Elektronen also musste es wohl 2 abgeben und das Magnesiumion ist nun zweifach positiv geladen ("2+" ). Die Reaktionsgleichung sieht in der 2. Tabelle anders aus. Da sie ja nun Elektronen abgeben und nicht aufnehmen, stehen die Elektronen jetzt auf der rechten Seite des Pfeils:
Probiere es einmal selbst aus, weil du es ja selber lernen musst, bei Fragen sag Bescheid.