Hilfe! Hybridisierung in Strukturformel erkennen?
Hallo, ich brauche dringen Eure Hilfe! Wie erkenne ich die Hybridisierung der Kohlenstoff- und Heteroatome in einer Strukturformel? Am Besten eine so vereinfachte Erklärung, dass es schon fast dumm klingt.
Mein Wissensstand liegt dabei, dass C mit Einfachbindung sp3, C mit DB sp2 und Dreifachbindung sp hybridisiert vorliegt.
DANKE!
Wie am Beispiel hier:
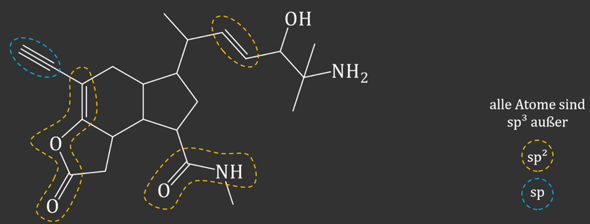
1 Antwort
Ganz schnell, kann man das schon an der Geometrie festmachen:
Bei sp3, sind 4 Bindungspartner tetraedrisch um den Kohlenstoff angeordnet.
Bei sp2 sind 3 Bindungspartner trigonal-planar um den Kohlenstoff angeordnet.
Bei sp liegen 2 Bindungspartner mit dem Kohlenstoff auf einer Geraden.
Da in der Chemie aber meistens zweidimensionale Projektionen der dreidimensionalen Struktur gezeichnet werden und Wasserstoffatome nicht zwingend mitgezeichnet werden, sind bei der sp3 Hybridisierung manchmal auch scheinbar 3 Bindungspartner trigonal-planar um den Kohlenstoff angeordnet (eigentlich ist es aber nicht planbar, das sieht nur auf dem Papier so aus). Schau dir daher am besten auf den 2. Blick an, was für Bindungen vom Kohlenstoff ausgehen:
Nur Einfachbindungen am Kohlenstoff: sp3-Hybridisierung. (Achtung: Wenn der Kohlenstoff eine positive Ladung trägt, liegt ein Carbokation vor und bei diesem ist der Kohlenstoff sp2-hybridisiert).
Genau eine Doppelbindung am Kohlenstoff: sp2-Hybridisierung.
Genau 2 Doppelbindungen oder eine Dreifachbindung am Kohlenstoff: sp-Hybridisierung.
Hallo,
Aber wieso ist auch die Einfachbindung zum N sp2-hybridisiert?
Bindungen sind nicht hybridisiert, man meint damit die Atome. Bei diesem sp2-Kohlenstoff liegen liegen drei sp2-Hybridorbitale vor und ein p-Orbital. Die drei sp2-Hybridorbitale bilden mit den Orbitalen vom benachbarten Kohlenstoff, Sauerstoff und Stickstoff je eine σ-Bindung. Das p-Orbital ist dann noch an einer zusätzlichen π-Bindung zum Sauerstoff beteiligt. Du hast also eine σ-Bindung zum benachbarten Kohlenstoff (Einfachbindung / ein Strich), eine σ-Bindung zum benachbarten Stickstoff (Einfachbindung / ein Strich) und zum Sauerstoff eine σ-Bindung und eine π-Bindung (Doppelbindung / zwei Striche). Wenn du dir hier unsicher bist, kannst du auch einfach Bindungen zählen: Genau eine Doppelbindung - sp2-Hybridisierung.
Wieso ist die Einfachbindung zum C im Fünfring dann nicht auch sp2-hybridiesiert, wenns immer um 3 Bindungspartner drum herum geht?
Weil du hier 4 Bindungspartner hast. Die Einfachbindungen der Kohlenstoffatome zu den Wasserstoffatomen werden in den Darstellungen in der Regel weggelassen, existieren in der Realität aber nach wie vor.
Wie sieht eigentlich ein nichtgebundenes, isoliertes C-Atom aus? Ist das irgendwie hybridisiert? Oder hat es tatsächlich 2s² 2p²-einfach-besetzte Orbitale? Irgendwie will es mir scheinen, dass diese Hybridisierung eine ähnliche modellhafte Krücke ist, wie der Dualismus von Teilchen und Welle.
DANKE!!! Ich habe gerade eine Ergänzung zu der Frage hinzugefügt. Am Beispiel habe ich noch nicht ganz die sp2-Hybridisierung verstanden. Dass ein C sp2-hybridisiert ist, wenn eine Doppelbindung zum O vorliegt, macht Sinn. Aber wieso ist auch die Einfachbindung zum N sp2-hybridisiert? Wieso ist die Einfachbindung zum C im Fünfring dann nicht auch sp2-hybridiesiert, wenns immer um 3 Bindungspartner drum herum geht?