Hilfe - Wann hat man Pufferbereiche?
An sich weiß ich, dass man ein Pufferbereich genau dort hat, wo ein Wendepunkt in der Titrationskurve vorhanden ist. Dort ist Konzentration der Säure gleich der Konzentration der konjugierten Base ist.. Bei mehrprotonierten Säuren hat man mehrere "Plateus", aber es gibt nur ein Pufferbereich (z.B. bei der Phosphorsäure). Bei Aminosäuren (z.B. Glycin) hat man hingegen 2 Pufferbereiche, obwohl es ebenfalls mehrprotonig (hier: zweiprotonig) ist.
Kann mir das jemand erklären?
3 Antworten
Ich sehe mit Schrecken, daß in meiner Antwort eine Graphik verlorengegangen ist, nämlich ausgerechnet die mit der Phosphorsäure, in der man alle drei Pufferbereiche sieht.
Da man Graphiken nur an frische Antworten, aber nicht an Kommentare, anheften kann, muß ich sie mit einer neuen Antwort nachtragen. Sonst hängen nämlich die folgenden Absätze aus meiner ersten Antwort in der Luft:
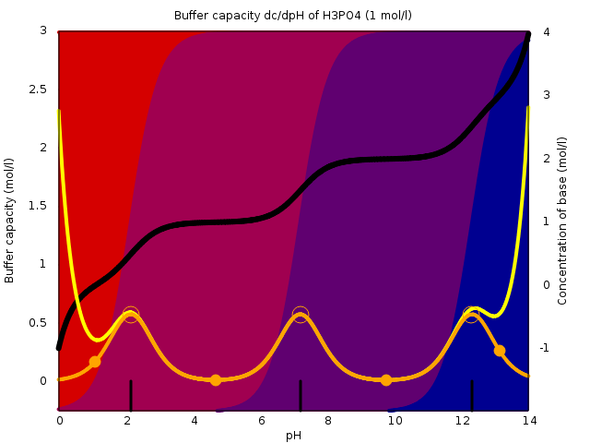
Du siehst die Speziesverteilung der H₃PO₄ (rot) bis PO₄³⁻ (blau) in Phosphat-Lösungen bestimmten pH-Wertes. Über weite pH-Bereiche gibt es nur eine Spezies, und dann hat die Lösung keine Pufferwirkung. Die Pufferkapazität ist die gelbe Kurve, je größer sie ist umso stärker puffert die Lösung — die orange Kurve ist die Pufferkapazität der Phosphat-Ionen allein, also ohne den Beitrag von H₃O⁺ und OH⁻.
Du siehst, daß die Pufferkapzität Maxima rund um die pKₐ-Werte hat (kleine schwarze Striche an der unteren Skala) hat.
Aus der Graphik (falls ich es richtig lese) würde ich sagen, dass die Pufferkapazität stets steigt, aber das macht doch gar keinen Sinn. Die Pufferkapazität ist im Pufferbereich am höchsten und wird davor und danach kleiner, d.h. da wäre ein Maximum
Du siehst doch, daß es beim Phosphat drei Pufferbereiche sind, nämlich genau rund um die drei pKₐ-Werte (2.148, 7.198, 12.319).
Nun liegen zwei dieser pKₐ-Werte ziemlich knapp am Rand der pH-Skala (0 bzw. 14). Bei diesen extremen pH-Werten puffern die H₃O⁺-Ionen (bzw. OH⁻-Ionen) bereits selbst, ohne Hilfe durch ein Paar von konjugierten Säuren/Basen. Das liegt einfach daran, daß eine Lösung mit pH=1 eben 0.1 mol/l H₃O⁺-Ionen enthält, und deshalb braucht man stöchiometrisch ziemlich viel OH⁻, um diesen pH zu verschieben, ganz ohne Gleichgewichte.
Dieser Anteil der Pufferkapazität, der nur vom pH abhängt, hat die Form ln(10)·( c(H₃O⁺) + c(OH⁻) ). Ich nenne diesen Anteil auch oft die „Pufferkpazität von Wasser“, weil sie nur vom Wassergleichgewicht bestimmt ist (ich habe einen Hang zu schrägen Terminologien; eine 0.1 mol/l HCl würde ich auch lieber als „Wasser mit pH=1“ nennen, weil außer dem Wasser kein weiteres Gleichgewicht drin vorkommt).
Die gelbe Kurve zeigt die echte Pufferkapazität der Lösung, und die orange zeigt den Beitrag der Phosphat-Ionen. Diese orange Kurve wird berechnet als Pufferkapazität der Lösung minus der Pufferkapazität von Wasser bei diesem pH (Formel im obigen Absatz).
Phosphat hat also durchaus drei schöne Maxima, aber zwei davon werden teilweise vom Wasser verdeckt.
Die Graphik stellt übrigens die Situation in einer Lösung dar, die 1 mol/l Phosphat (=Summe aller Spezies) enthält. Für einen Puffer wäre das ziemlich konzentriert, und bei einem 0.1 mol/l Puffer wären die drei Maxima nur ein Zehntel so hoch; die beiden am Rand würden dann fast völlig unter der Pufferkapazität vom Wasser verschwinden.
Achso und die Phosphat Ionen puffern tatsächlich gar nicht in den linken und rechten Bereichen?
Die orange Kurve sind nur die Phosphat-Ionen, und Du siehst ja daß sie puffern. Aber bei so extremem pH puffern H₃O⁺ und OH⁻ eben auch, und die echte, beobachtbare Pufferkapazität wird ganz am Rand von diesen beiden Ionen bestimmt. Deshalb sind Puffer um den pK₁ und pK₃ bei der Phosphorsäure wenig sinnvoll.
Ein H₃PO₄/H₂PO₄⁻-Puffer kann gerade noch nützlich sein — der wäre bei pH≈2.1 aktiv, aber unterhalb von etwa 1.7 puffert bereits das Wasser stärker als das Phosphat.
Ein HPO₄²⁻/PO₄³⁻-Puffer hat dagegen so gut wie keinen Sinn. Er wäre um pK≈12.3 aktiv, aber bei diesem pH puffert bereits das OH⁻ so stark, daß der Puffer keinen Sinn ergibt.
Bei einem Puffer handelt es sich um eine Säure und ihre konjugierte Base.
Wenn die Säure nun Phosporsäure (H3PO4) ist, dann ist die konjugierte Base Dihydrogenphosphat (H2PO4 -)
Wenn aber die Säure Natriumdihydrogenphosphat (NaH2PO4) ist, dann ist die konjugierte Base Dinatriumhydrogenphosphat (Na2HPO4)
Im Gegensatz zur Phosphorsäure ist eine Aminosäure eine organische Verbindung und diese besitzt zwei funktionelle Gruppen. Du solltest hier nicht Äpfel mit Birnen vergleichen wollen.
Gruß
Henzy
Ja klar sind das zwei unterschiedliche Paar Schuhe, daher war ja meine Frage "Wann hat man Pufferbereiche".. Also wieso hat man bei Aminosäuren zwei Pufferbereiche und bei Phosphorsäure einen
So wie ich es jetzt verstanden habe, haben Aminosäuren zwei Pufferbereiche, weil sie als Anion bzw. Zwitterion vorliegen können oder als Kation bzw. Zwitterion..
Phosphorsäure hat nur ein Anion, dennoch hat es Dissoziationsstufen und ich verstehe nicht, wieso dort nicht mehrere Pufferbereiche auftreten
Einen Puffer hast Du genau dann, wenn eine Säure und ihre konjugierte Base nebeneinander vorliegen. Also z.B. Essigsäure und Acetat — in diesem einfachen Fall ist das bei pK ≈ pKₐ gegeben, bei pH ≪ pKₐ hast Du nur Säure und bei pH ≫ pKₐ hast Du nur Acetat in der Lösung.
Bei Phosphorsäure ist es genauso. Weil es drei pK-Werte gibt, gibt es auch drei Pufferbereiche, aber zwei davon liegen ziemlich am Rand der pH-Skala, und da puffern auch die H₃O⁺ bzw. OH⁻ bereits kräftig, so daß diese Puffer weniger nützlich sind als der H₂PO₄⁻/HPO₄²⁻-Puffer im Neutralen.
Die angehängte Graphik zeigt das im Detail. Du siehst die Speziesverteilung der H₃PO₄ (rot) bis PO₄³⁻ (blau) in Phosphat-Lösungen bestimmten pH-Wertes. Über weite pH-Bereiche gibt es nur eine Spezies, und dann hat die Lösung keine Pufferwirkung. Die Pufferkapazität ist die gelbe Kurve, je größer sie ist umso stärker puffert die Lösung — die orange Kurve ist die Pufferkapazität der Phosphat-Ionen allein, also ohne den Beitrag von H₃O⁺ und OH⁻.
Du siehst, daß die Pufferkapzität Maxima rund um die pKₐ-Werte hat (kleine schwarze Striche an der unteren Skala) hat.
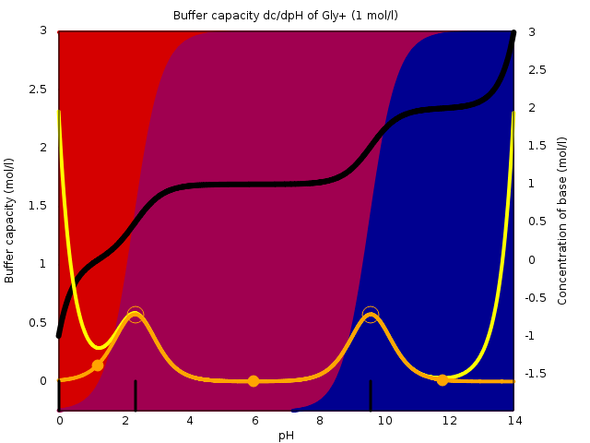
Bei Glycin ist es ähnlich, man hat einen Pufferbereich rund im pH 10, der ist gut nutzbar, aber der andere liegt im Sauren und verschwindet bereits halb in der Pufferkapazit von H₃O⁺.
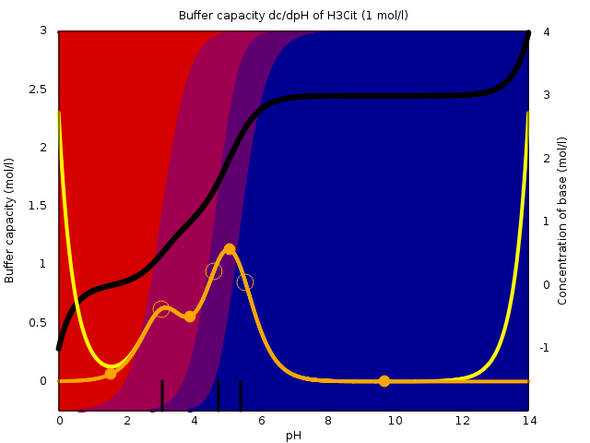
Ein anderer Fall ist Citrat, da sind die pKₐ-Werte einander sehr ähnlich, und man bekommt einen großen, breiten Pufferbereich mit insgesamt vier verschiedenen Spezies.
Danke für die Veranschauchlichung :) Aber ich habe immer noch nicht so ganz verstanden, wieso bei der Phosphorsäure nur ein Pufferbereich gibt, obwohl es mehrere Dissoziationsstufen vorhanden sind :/