Formalladung hier richtig?
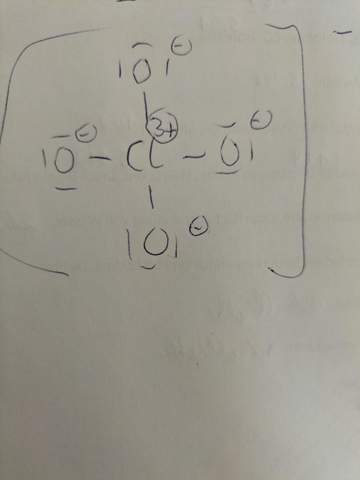
Ist das richtig?
2 Antworten
Das ist nicht richtig. Richtiger für das Perchlorat-Anion ist folgende Darstellung:
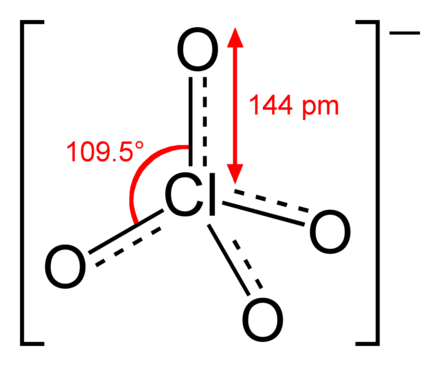
Dabei sind die jeweils freien Elektronenpaare an den Sauerstoffatomen weggelassen worden. Die Darstellung soll verdeutlichen, dass alle Sauerstoffe gleichartig sind und die Cl-O-Bindungen gleichen Anteil an Doppelbindungscharakter haben. Die Oxidationszahl (OZ) des Chlors ist hier +VII. Die 4 Sauerstoffe liefern 4 * -II = OZ -VIII. Die Differenz der OZ ist die Ladung des Ions mit einer negativen Ladung.
Oder vielleicht ist diese Darstellungsform eher dass, was in der Schule erwartet wird:
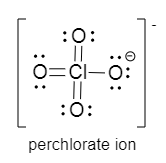
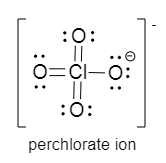
Ja, das passt.
Ich hatte die erweiterte Version mit Mehrfachbindungen schon angefangen, aber bin zur Ansicht gelangt, dass die eher verwirrt.
Ein wenig Schnuppern in einem PC-Buch hat zur Erkenntnis geführt, dass diese Verwirrung auf Schulniveau auch nicht entwirrt werden kann. Es sind da hybridisierte sp-p-sp-Sigma-Dreizentrenbindungen im Spiel, und von der Bindungsordnung bleibt es bei 4.
Nun ich meine eher die Darstellungsart mit 4 geladenen Sauerstoffatomen und einem 3-fach positiv geladenen Chloratom sieht für mich doch sehr exotisch aus. Macht man das heute in der Schule so?
Auch wenn ich es auf Schulniveau nicht besser darstellen kann - wohl ist mir nicht bei solcher Ladungstrennung.
Wohl ist mir dabei auch nicht, aber wenn man an der Oktettregel festhält, sind die Formalladungen richtig, und danach war gefragt.
Ehrlich?