Die Konzentration von Zitronensäure in einer Zitrone?
Hallo,
ich schreibe eine Chemie Facharbeit und soll die Konzentration von Zitronensäure in der Zitronen herauszufinden. Anhand der Titration mit NaOH sind bekannt, dass 48ml NaOH gebraucht wird, um 5ml Zitronensaft(frisch gepresst) mit 50ml Wasser gemischt, zu neutralisieren. NaOH Konzentration ist c = 0,1 mol/l. Und ich weiss das in einer Zitrone ca. 5-8% Zitronensäure ist. Ich habe jetzt c1 *v1 = c2 * v2 gerechnet: c1*50ml = 0,1ml/l * 48ml und habe 0.096mol raus, aber muss ich die 5-8% auch beachten? Und ist es richtig dass ich fuer c1 50ml eingesetzt habe? Bitte helft mir.
1 Antwort
Du mußt beachten, daß Zitronensäure eine dreibasige Säure ist, also drei H⁺ abgeben kann. Um das genauer zu verstehen, sehen wir uns die Titrationskurve (pH vs. Zugabe von Maßlösung) an:
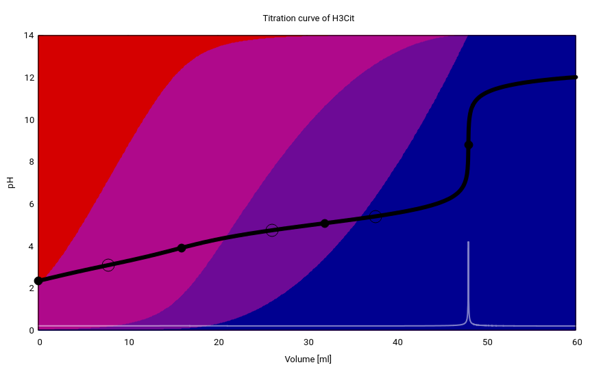
Am Anfang liegt überwiegend undissoziierte Zitronensäure vor (roter Hintergrund). Im Lauf der Titration entstehen daraus Dihydrogencitrat und Monohydrogencitral (violette Zwischentöne), aber der pH springt erst, wenn alle Zitronensäure zum Citrat (blau) umgesetzt ist:
H₃Cit + 3 NaOH ⟶ Na₃Cit + 3 H₂O
Du verbrauchst V=48 ml NaOH der Konzentration c=0.1 mol/l, das sind n=cV=4.8 mmol NaOH. Da aber 3 mol NaOH zum Neutralisieren von 1 mol Zitronensäure erforderlich sind, betrug die Stoffmenge an Zitronensäure im Kolben nur n=1.6 mmol; die waren in V=5 ml Zitronensaft enthalten, also beträgt die Stoffmengenkonzentration der Zitronensäure im Saft c=n/V=0.32 mol/l bzw. γ=cM=61.5 g/l. Unter Annahme einer Dichte von ρ≈1 g/ml für den Zitronensaft sind das gut 6%, also innerhalb des erwarteten Intervalls.
Naja, wenn wir annehmen, daß die Dichte von Zitronensaft ρ≈1 g/ml beträgt, dann wiegt ein Liter 1000 g, und 61.5g davon sind Zitronensäure.
Vielen Dank!! Können Sie mir bitte noch kurz erklären wie Sie das mit den 6% ausgerechnet haben? Danke Ihnen💗