Berechnung der Aktivierungsenergie ?
Hallo ich hab eine Frage und zwar lautet meine Aufgabe: ,,Die Geschwindigkeitskonstante k steigt um 50 % an, wenn die Temperatur von 25 °C auf 30 °C erhöht wird. Wie groß ist die Aktivierungsenergie der Reaktion? Hinweis: Nehmen Sie an, dass der präexponentiellefaktor a konstant bleibt.´´
mein Ansatz ist: 0,5•k(25°C)=k(30°C) -> k(25°C)/k(30°C)=2
ich hab als aktivierungsenergie -104178,65 J/mol raus.
aber das Ergebnis ist +104178,65 J/mol… ich denke das vielleicht mein Ansatz falsch ist
kann mir jemand vielleicht helfen um auf das richtige Ergebnis zu kommen ?
2 Antworten

k(25°C)/k(30°C)=2
Das ist ein fast vernünftiger Ansatz, nur daß Du Zähler und Nenner verwechselt hast (es gilt ja k(25 °C) < k(30 °C). Wenn Du das richtigstellst und in die Arrhenius-Gleichung einsetzt (T₁=298.15 K und T₂=302.15 K), dann bekommst Du
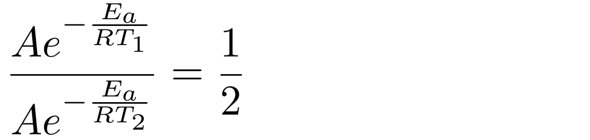
Die Vorfaktoren A kürzen sich heraus, und nach Logarithmierung der Gleichung erhältst Du
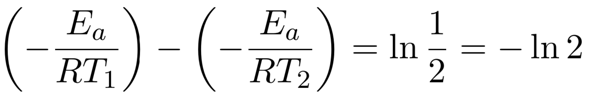
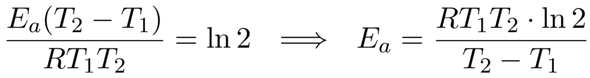
Nachdem man ein negatives Vorzeichen global eliminiert, kann man die linke Seite auf gemeinsamen Nenner bringen
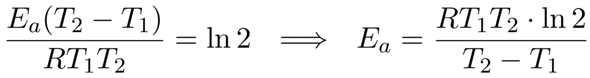
Und wenn man die Zahlen einsetzt, bekommt man Eₐ=104 kJ/mol.
Zwei Bemerkungen sind noch notwendig:
- Deine Angabe der Lösung mit 8 Dezimalstellen ist kompletter Bullshit und würde Dir bei mir Punkteabzug einbringen, selbst wenn alles andere richtig wäre.
- Aktivierungsenergien sind immer positiv, denn diese Energie muß man ja ins System reinstecken, damit die Reaktion ablaufen kann. Negative Aktivierungsenergien gibt es im strikten Sinn nicht; zwar kann eine in mehreren Schritten ablaufende Reaktion einen negativen Temperaturkoeffizienten haben (also bei hoher Temperatur langsamer sein als bei niedriger), aber trotzdem hat jeder Elementarschritt eine positive Aktivierungsenergie (und daher einen positiven Temperaturkoeffizienten).
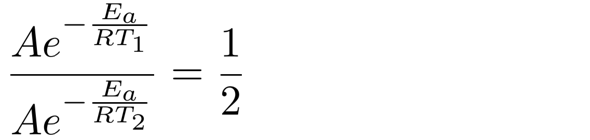
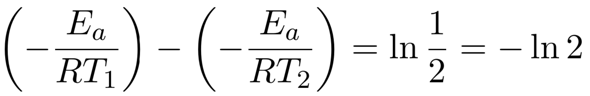

Danke für die Hilfe ! ich habe alles verstanden außer meinen Fehler beim Ansatz. Ich verstehe nicht wieso auf der recht Seite deiner Gleichung 1/2 steht, weil wenn man es umformt nach k1/k2 kommt eine 2 raus ? Oder mache ich das falsch 😅

Ich weiß durch dich und picus48 das 0,5 als Faktor falsch ist, aber trotzdem irritiert mich diese Umformung zu k1/k2=0,5 . Ich würde das gerne verstehen für den Fall sowas rankommt 😅

Die Geschwindigkeitskonstante k steigt um 50 % an, wenn die Temperatur von 25 °C auf 30 °C erhöht wird
Vermutlich heißt das: Wenn die Geschwindigkeitskonstante bei 25 °C den Wert k₁=100 (in irgendwelchen Einheiten) hat, dann ist sie bei 30 °C k₂=150, denn 50% von 100 sind 50, und die kommen dazu. Also ist k₂/k₁=1.5, und das gilt in allen Einheiten, weil es nur ein Verhältnis ist und selbst keine Einheit hat.

Dankeschön für die Hilfe ich hab jetzt alles verstanden 😊

Deinen Ansatz verstehe ich absolut nicht. Du rechnest da mit Celsiusgraden, was ohnehin Kappes ist.
Der Zusammenhang zwischen der Geschwindigkeitskonstanten k und der Aktivierungsenergie EA kann (bei Vernachlässigung des Aktivierungsvolumens bzw. bei niedrigen Drücken) in vielen Fällen durch die Arrhenius-Gleichung[mit dem präexponentiellen Frequenzfaktor A und der Gaskonstante R beschrieben werden.
Sind zwei Geschwindigkeitskonstanten ( k1 und k2) einer Reaktion bei zwei Temperaturenturen (T1 und T2) bekannt, lässt sich mit:
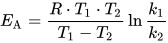
Die Aktivierungsenergie berechnen. https://de.wikipedia.org/wiki/Aktivierungsenergie
Die Temperaturen müssen auf der Basis der Kelvinskala eingegeben werden. Und wenn die Geschwindigkeitskonstante k2 um 50 % größer ist als k1, dann heißt das in mathematischer Gleichung:
k2 = 1,5 * k1
Die blöde Rechnerei überlasse ich nun Dir und schaue mir gerne das Ergebnis an.
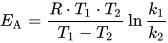


Die beiden Nachkommastellen kannst Du getrost weglassen und auf 61 kJ/mol aufrunden. Und die Einheit für Joule bekommt einen GROßES J.
Hmm, nachdem ich die Antwort von Picus48 gelesen habe, komme ich zum Schluß, daß er recht und ich unrecht habe — denn „steigt um 50%“ heißt ja wirklich Faktor 1.5, nicht Faktor 2. Folglich beträgt die Aktivierungsenergie nur 61 kJ/mol, was auch ein etwas plausiblerer Wert ist.