Anordnung in Strukturformeln?
Hallo
Ich habe eine Frage zur Chemie. Wie komme ich bei einem Molekül, bei dem es theoretisch mehrere Anordnungsmöglichkeiten gibt, auf die korrekte Variante?
Als Beispiel habe ich das Molekül HClO3, siehe Bild.
Wie weiss ich jetzt, dass die linke Anordnung richtig ist und wieso ist die rechte Anordnung falsch? Wie komme ich bei anderen Molekülen auf die eine richtige Lösung?
Danke für die Hilfe!

5 Antworten
Tatsächlich ist die linke Darstellung die gebräuchlichere, wobei Chlorsäure so auch nicht in der Regel dargestellt wird.
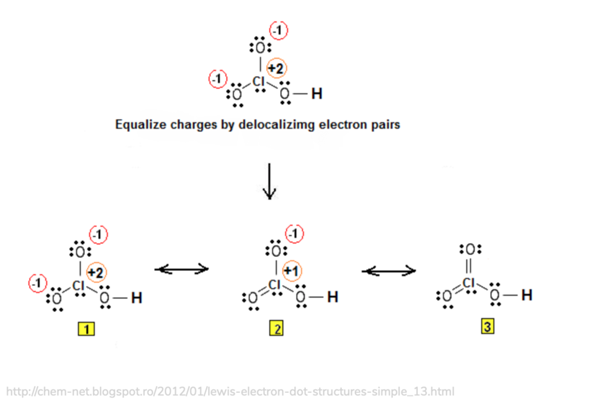
Hier eine Abbildung, auf der du sehen kannst, was ich mit der Darstellungsform meine. Die tatsächliche Darstellungsweise ist die 3, beider das Molekül keine Ladungen oder Partialladungen trägt.
Vielleicht hilft dir das erstmal weiter und du kannst dir ein paar Dinge erschließen?

Wirklich herleiten kann man sich das nicht. Und es bildet sich ein Gleichgewicht bei zwischen den beiden Formen. Bei der Chlorsäure liegt das wie auch bei der Schwefeligen Säure auf Seiten der Form mit dem freien Elektronenpaar am Zentralatom. Bei der Phosphonsäure <-> Phosphorigen Säure ist es anders.
Also gilt einmal mehr, dass man sowas einfach lernt. Einige wenige mögen das herleiten können, ich kann es jedenfalls nicht.
Verguckt. Das rechte hat mehr ungünstige Konfigurationen beim Sauerstoff.
Du kannst den Sauerstoff auch als Dopplebindung an das Chlor binden


Keine davon ist richtig. Die Linke wäre richtig, aber Chlor besitzt 7 Valenzelektronen und deshalb sollten die Einfachbindungen zu dem Sauerstoff ob und unten eigentlich Doppelbindungen sein, damit alle 7 Valenzelektronen ein Elektronenpaar mit den vom jeweiligen Sauerstoff eingehen können.