Ziehen sich Edelgase gegenseitig an?
Wenn sich 2 Atome nahe genug kommen, ziehen sich der Kern und die Elektronenwolke gegenseitig an, die Elektronenwolken werden zwischen die Kerne gezogen, bis ein Gleichgewichtsabstand erreicht ist.

Warum passiert das nicht zwischen Elementen mit s2p6-Konfiguration?
Ich weiß, dass sich Edelgase nicht miteinander binden, aber sollten sie sich nicht trotzdem anziehen wie in (e)?
2 Antworten

Moin,
wenn sich zwei Edelgasatome einander annähern, gibt es auch eine Art Interaktion zwischen beiden, aber die sieht eher so aus:
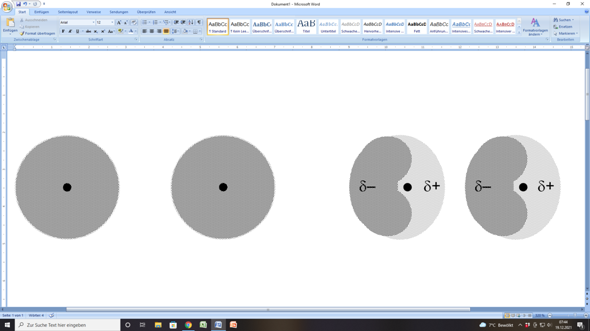
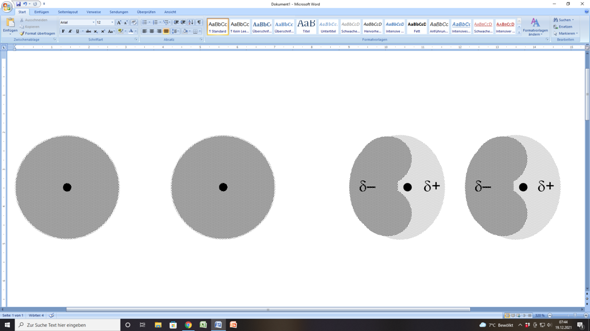
Bei einzelnen Atomen ist die Elektronenhülle mehr oder weiniger konzentrisch um den Atomkern verteilt. Dabei kommt es (vor allem bei großen Atomen) auch hin und wieder zu einer leichten Ungleichverteilung der Elektronendichte. Wenn du so willst, wabert die Elektronendicht leicht hin und her.
Kommt nun ein anderes Edelgasatom in die Nähe eines Edelgasatoms, bei dem gerade zufällig eine solche Ungleichverteilung der Elektronendichte vorliegt, so wird in dem anderen Edelgasatom eine ähnliche Ungleichverteilung der Elektronendichte ausgelöst (induziert). Da nun bei beiden Edelgasatomen eine Seite der Elektronenhülle eine etwas höhere Elektronendichte aufweist, ergeben sich in den Elektronenhüllen negativ und positiv teilgeladene Bereiche; es entstehen Dipole.
Und weil dieser Dipolzustand bei dem einen Edelgasatom durch das andere ausgelöst wurde, handelt es sich bei ihm um einen induzierten Dipol.
Nun ziehen sich der negativ teilgeladene Bereich des einen Edelgasatoms und der positiv teilgeladene Bereich des anderen Edelgasatoms durchaus gegenseitig an. Das Bezeichnet man als van-der-Waals-Wechselwirkung.
Die gibt es zwischen allen Masseteilchen auf atomarem Niveau, also auch zwischen Edelgasatomen.
Aber das, was in deiner Abbildung gezeigt wird, ist das Zustandekommen einer Atombindung. Das ist etwas anderes, weil es bei Atomen, die so etwas machen, Bereiche gibt, in denen ungepaarte Elektronen vorkommen.
Wenn sich zwei solche Atome einander annähern, kommt es zu Wechselwirkungen, bei denen neue Orbitale (Elektronenaufenthaltswahrscheinlichkeitsräume) gebildet werden, die zwischen den beiden Atomrümpfen liegen. Dabei entstehen Räume, die energetisch günstiger sind (bindende Elektronenpaarorbitale) und solche, die energetisch ungünstiger liegen (antibindende Elektronenpaarorbitale).
Tja, und wenn nun die günstigeren bindenden Orbitale mit den einzelnen Elektronen besetzt werden können, die ungünstiger liegenden dagegen nicht besetzt werden, kommt es zu einer Atombindung, also zu bindenden Elektronenpaaren, die von beiden Atomrümpfen zur gleichen Zeit gemeinsam genutzt werden.
Bei Edelgasatomen ist es nun aber so, dass sie keine ungepaarten Elektronen in ihrer Hülle haben. Darum würden hier sowohl die bindenden Orbitale als auch die antibindenden Orbitale mit Elektronen befüllt werden, das heißt, dass die Edelgasatome zwar gemeinsame Elektronen hätten, die energetisch günstiger unterkommen würden als im Einzelatomzustand, aber eben auch solche, deren Energiegehalt ungünstiger wären. Darum kommt es nicht zu der in Bild e deiner Abbildung zu sehenden Interaktion, sondern höchstens zur Ausbildung von schwachen van-der-Waals-Wechselwirkungen...
LG von der Waterkant

Na ja, zum einen sind das alles Beschreibungen und Darstellungen von Modellvorstellungen, die wir Menschen uns vom atomaren Mikrokosmos machen. Zugegeben, viele dieser Modelle sind wirklich sehr brauchbar, um diese Welt zu verstehen. Andererseits bleiben es Modellvorstellungen. Und Modelle haben stets Grenzen und sind niemals die Wirklichkeit selbst. Aber wenn die Modelle verständlich sind, neigen wir Menschen dazu, sie für die Wirklichkeit zu halten!
Was deine Abbildung angeht, so wird hier versucht, die Vorstellung des Zustandekommens einer Atombindung mit dem Orbitalmodell des Atombaus zusammen zu bringen. Die kleinen orangefarbenen Pünktchen sollen ein (!) Elektron sein, das mit seinem gewissen Energiegehalt rund um den Atomkern verteilt an verschiedenen Stellen liegt. Dabei gibt es Orte, wo es häufiger anzutreffen ist und solche, wo es seltener ist. Im Grunde betrachtest du hier die Übereinanderlagerung von Tausenden Einzelmomenten. Und das ergibt dann eine nahezu kugelsymmetrische Verteilung des Elektrons rund um den Atomkern mit ausgefranztem Rand.
Wenn nun dieses Atom in die Nähe eines anderen Atoms kommt, übt der eigene, aber eben auch der andere Atomkern eine anziehende Wirkung auf die (beiden) Elektronen aus. Da die Elektronen beide ungepaart sind, können sie sich irgendwann in einem neuen Orbital zwischen den Atomkernen aufhalten, so dass am Ende ein Zustand erreicht wird, in dem es zu einer Atombindung kommt, weil sich die Elektronen auch sehr häufig zwischen den Atomkernen befinden (= bindendes Elektronenpaar).
Das, was ich dargestellt habe, ist ein Bild, wenn du zwei Atome mit jeweils mehreren Elektronen betrachtest (Mehrelektronensysteme). Und da kommt es zu besagten Elektronendichteschwankungen, zur Induktion von Dipolen und in deren Folge zu van-der-Waals-Wechselwirkungen.
Das ist - wie schon gesagt - etwas anderes.
Die Ausbildung eines Molekülorbitals, in dem sich dann bindende Elektronenpaare aufhalten können, ist nur möglich, wenn die Atome über einzelne (ungepaarte) Elektronen verfügen. Und genau das haben Edelgasatome nicht. Deshalb zeigen sie van-der-Waals-Wechselwirkungen, aber eben keine Ausbildung einer Atombindung.

Danke!
"Wenn nun dieses Atom in die Nähe eines anderen Atoms kommt, übt der eigene, aber eben auch der andere Atomkern eine anziehende Wirkung auf die (beiden) Elektronen aus." - also ja so wie in (e) ja dargestellt.
Aber warum ist gerade die Anziehung zwischen Kern und "Elektronenwolke" stärker als die Abstoßung zwischen den Elektronenwolken? Liegt das einfach daran, dass der Kern an sich stationär ist und die Elektronenwolke in der Wahrscheinlichkeitsdichte um den Kern herumverteilt ist und somit die Abstoßung zwischen beiden Elektronen der H Atome geringer ist?
Weil dann würde es ja Sinn ergeben, dann könnten die Kerne die Elektronen erstmal anziehen weil der Abstand von Kern-Elektronenwolke geringer ist als Kern-Kern.
Dann müsste sich ja jedes Element erstmal so anziehen, auch Edelgase gegenseitig, nur wird spätestens durch die Überlappung der Orbitale ein viel stärkeres antibindenes orbital gebildet und sie stoßen sich wieder ab

Ja, so kannst du das beschreiben.
Übrigens: Wenn du es schaffst, die Coulomb-Abstoßungskraft zwischen den gleich geladenen Protonen von Atomkernen zu überwinden (was allerdings ziemlich schwierig ist), kommt es sogar dazu, dass sich die Protonen gegenseitig anziehen, weil sie beim Unterschreiten der Coulomb-Abstoßung von einer viel größeren Kraft, der Kernkraft oder auch Starken Wechselwirkung, zusammengehalten werden. Das bezeichnet man dann als Kernfusion. Das passiert zum Beispiel auf unserer Sonne...
LG von der Waterkant (again)

"Wenn sich 2 Atome nahe genug kommen, ziehen sich der Kern und die Elektronenwolke gegenseitig an."
Nein, tun sie nicht.
Im Gegenteil. Die Elektronen stoßen sich gegenseitig ab, weil sie alle negativ geladen sind. Die Atomkerne stoßen sich ebenfalls gegenseitig ab, weil sie positiv geladen sind.


Laut dir würde es nie zu einer kovalenten Bindung kommen, oder überhaupt zu irgendeiner Bindung
Vielen Dank für die Antwort, bis jetzt einer der besten (habe die Frage auch auf anderen Plattformen gestellt).
Mir kommt nur die Frage auf, dass in dem Buch (Chemical Principles) aus dem die Abbildung kommt die Interaktion am Anfang dadurch Zustandekommt, dass der Kern des einen die Wolke des anderen anzieht und sich so erstmal die Elektronenwolken zwischen die Kerne ziehen (so steht es im Text), wobei es ja eigentlich eher so aussehen sollte wie in deiner Abbildung.