wieso ist SO4 eine kovalente Bindung?
wieso ist SO4 eine kovalente Bindung es ist doch eigentlich eine Ionenbindung weil S 6 Elektronen an die Sauerstoffatome angibt
1 Antwort
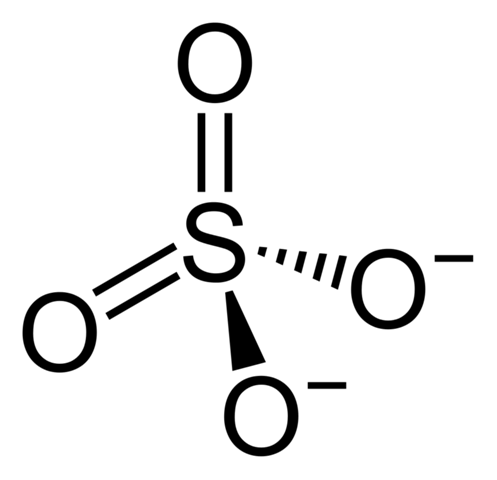
Also die Prämisse, dass 6 abgegebene Elektronen eine ionische Bindung bedingen ist so nicht richtig. Aber dass das Sulfat-Ion bindungstechnisch etwas aus der Reihe fällt stimmt schon. Zunächst mal überschreitet der Schwefel ja formal das Oktett. Wie erklärt man das jetzt? Nun, die Lewis-Formel, die man normalerweise für das Sulfat zeichnet, also die hier:
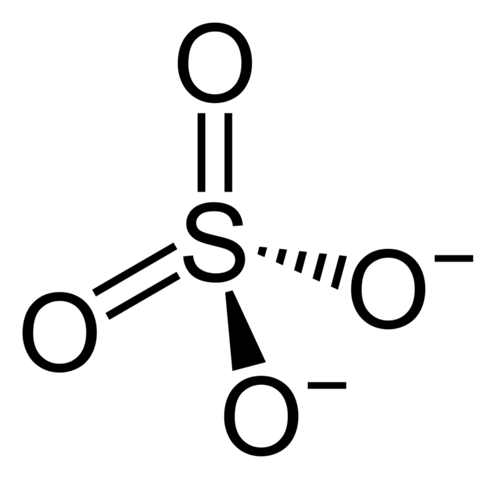
ist so eigentlich falsch. Denn sie impliziert 6 kovalente Bindungen, die gibt es da so aber nicht.
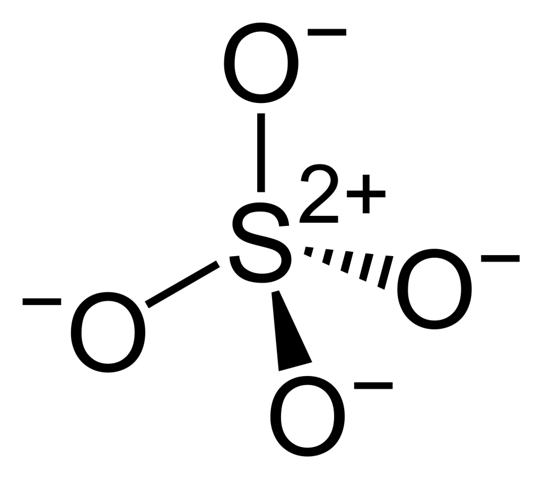
Die "richtigere" Variante ist diese hier:
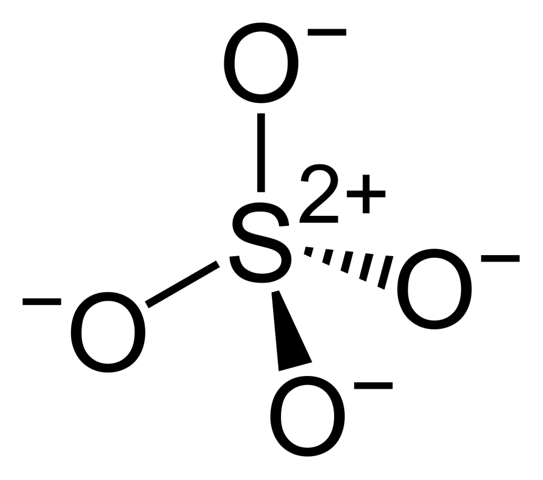
Hier sieht man auch den ionischen Anteil an den Bindungen etwas besser. Pi-Bindungen gibt es aber trotzdem auch noch (die sind hier delokalisiert). Also es ist schon noch Doppelbindungscharakter vorhanden, nur eben nicht so, wie das die erste Zeichnung andeutet. Die reale Bindungssituation im Sulfat lässt sich zeichnerisch also nur schwer umsetzen.